
Wetenschap
Hoe verschilt de kristallijne structuur van een metaal van een ionische verbinding zoals natriumchloride of cesiumchloride?
Metallic binding:
* metaalatomen: Metalen bestaan uit een rooster van positief geladen metaalionen omgeven door een "zee" van gedelokaliseerde elektronen. Deze elektronen zijn niet gebonden aan een bepaald atoom en zijn vrij om door de hele structuur te bewegen.
* sterk en niet-directioneel: De metalen binding is sterk en niet-directioneel, wat betekent dat de aantrekkelijke krachten tussen de ionen en elektronen in alle richtingen gelijk zijn. Dit zorgt voor een nauwe verpakking van atomen, wat resulteert in hoge dichtheden en goede geleidbaarheid.
* kristalstructuren: Metalen vertonen typisch verschillende kristalstructuren, zoals gezichtsgerichte kubieke (FCC), lichaamsgerichte kubieke (BCC) en zeshoekige dichtbij (HCP). Deze structuren worden bepaald door de grootte en het verpakken van de metaalatomen.
ionische binding:
* ionen: Ionische verbindingen bestaan uit tegengesteld geladen ionen die bij elkaar worden gehouden door elektrostatische krachten. Deze ionen worden meestal gevormd door de overdracht van elektronen van een metaal naar een niet-metaal.
* sterk en directioneel: De ionische bindingen zijn sterk en directioneel, wat betekent dat de aantrekkelijke krachten het sterkst zijn tussen tegengesteld geladen ionen. Dit leidt tot een meer geordende structuur met specifieke geometrische regelingen.
* kristalstructuren: Ionische verbindingen gebruiken meestal eenvoudige kristalstructuren zoals de gezichtsgerichte kubieke (NaCl-structuur) of de eenvoudige kubieke (CSCL-structuur). Deze structuren worden bepaald door de lading en de grootte van de ionen, gericht op het minimaliseren van elektrostatische afstoting en het maximaliseren van de aantrekkingskracht.
Belangrijkste verschillen:
* binding: Metalen hebben gedelokaliseerde elektronen en niet-directionele bindingen, terwijl ionische verbindingen gelokaliseerde elektronen en directionele bindingen hebben.
* geleidbaarheid: Metalen zijn goede geleiders van warmte en elektriciteit vanwege hun vrij bewegende elektronen, terwijl ionische verbindingen typisch isolatoren in hun vaste toestand zijn.
* kneedbaarheid en ductiliteit: Metalen zijn kneedbaar (kunnen in vellen worden gehamerd) en ductiel (kan worden getrokken in draden) vanwege het vermogen van metaalionen om langs elkaar te glijden zonder de bindingen te verbreken. Ionische verbindingen zijn over het algemeen bros en zullen uiteenvallen op stress vanwege de sterke directionele bindingen.
Voorbeelden:
* Natriumchloride (NaCl): NACL neemt een gezichtsgerichte kubieke (FCC) -structuur aan met afwisselend Na+ en clionen.
* cesiumchloride (CSCL): CSCL neemt een eenvoudige kubieke structuur aan met een CS+ -ion in het midden van de kubus en climes in elke hoek.
* koper (cu): Koper heeft een gezichtsgerichte kubieke (FCC) structuur.
Inzicht in de verschillen in binding en structuur verklaart de verschillende eigenschappen van metalen en ionische verbindingen.
 Wat is een covalente verbinding die oplost in water?
Wat is een covalente verbinding die oplost in water?  Kun je de formule laten zien om het oxidatiegetal van chroom in Na2Cr2O7 te vinden?
Kun je de formule laten zien om het oxidatiegetal van chroom in Na2Cr2O7 te vinden?  Wanneer een vloeistof blauw lakmoespapier rood kleurt, geeft dit aan dat het een?
Wanneer een vloeistof blauw lakmoespapier rood kleurt, geeft dit aan dat het een?  Welke vaste stoffen lossen op in water om een kleurloze oplossing te vormen?
Welke vaste stoffen lossen op in water om een kleurloze oplossing te vormen?  Hoe kunt u berekenen van Corrrogated Box PSI?
Hoe kunt u berekenen van Corrrogated Box PSI?
Hoofdlijnen
- Wat levert bloed aan je lichaamsweefsels?
- Hoe de inheemse praktijk van goed vuur onze bossen kan helpen gedijen
- Welk type organisme zou de structuurnucleus gebruiken?
- Onderzoek toont aan dat hommelnesten oververhit raken als gevolg van de klimaatverandering, waardoor toekomstige populaties worden bedreigd
- Wat zijn de belangrijkste 2 fasen van de celcyclus?
- Een kijkje in de geest van de hond:nieuw onderzoek onthult hoe honden over hun speelgoed denken
- Wat is een geïsoleerd systeem in de fysieke wetenschap?
- Wat is de monomeer of subeenheid van koolhydraatstructuur?
- Wat is een voorbeeld van een wetenschappelijke veldhoeveelheid?
- Unieke organische lichtemitterende moleculaire emitters
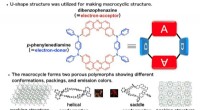
- Microanalyse van biologische monsters voor vroege detectie van ziekten
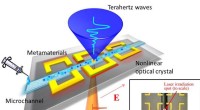
- Onderzoek geeft nieuw inzicht in de evolutie van het zenuwstelsel

- Er zijn twee nodig:een katalysator met twee atomen, dat wil zeggen:zuurstof maken uit water
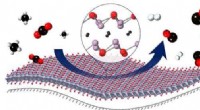
- Katalysator voor duurzame gassynthese
 Wat is het kenmerk van een celmembraan dat regelt welke stoffen cel kunnen binnenkomen en verlaten?
Wat is het kenmerk van een celmembraan dat regelt welke stoffen cel kunnen binnenkomen en verlaten?  Wat is een andere naam voor infraroodergie?
Wat is een andere naam voor infraroodergie?  Waarom verdelen wetenschapper de aarde in twee verschillende sets lagen?
Waarom verdelen wetenschapper de aarde in twee verschillende sets lagen?  Hybride membraan zorgt voor opschudding op de wereldmarkt
Hybride membraan zorgt voor opschudding op de wereldmarkt Wat gebruiken wetenschappers vaak om micro-evolutie te bestuderen?
Wat gebruiken wetenschappers vaak om micro-evolutie te bestuderen?  Wat meet je de temperatuur van heet gas?
Wat meet je de temperatuur van heet gas?  Hoe rode muggen te identificeren
Hoe rode muggen te identificeren Wat is definitie opgeslagen mechanische energie?
Wat is definitie opgeslagen mechanische energie?
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap © https://nl.scienceaq.com

