
Wetenschap
Wat zijn de patronen over periode 3 pH van waterige chloride -oplossingen?
Inzicht in de relatie
* metaalchloriden en hydrolyse: Wanneer metaalchloriden (zoals NaCl, Mgcl₂, Alcl₃) oplost in water, kunnen de metaalkationen interageren met watermoleculen. Deze interactie kan leiden tot hydrolyse, waarbij het metaalkation elektronen van het zuurstofatoom van water aantrekt, waardoor de O-H-binding wordt verzwakt. De resulterende H⁺ -ionen dragen bij aan de zuurgraad.
* Niet -metalen chloriden en hydrolyse: Niet -metalen chloriden (zoals SICL₄, PCL₃, SCL₂) reageren krachtig met water en produceren zure oplossingen. De reactie omvat de vorming van oxoacides (zoals HCLO₄, H₃po₄, H₂so₄) die sterke zuren zijn.
Periode 3 trends
1. Natriumchloride (NaCl): NaCl is een neutraal zout; De oplossing is noch zuur noch basic. Natriumionen (Na⁺) hydrolyseren niet significant.
2. magnesiumchloride (mgcl₂): MGCL₂ -oplossingen zijn enigszins zuur. Het mg²⁺ -ion is een zwakkere Lewis -zuur in vergelijking met Al³⁺, maar het ondergaat nog steeds wat hydrolyse om H⁺ -ionen af te geven.
3. aluminiumchloride (alcl₃): Alcl₃ -oplossingen zijn zuur. Het Al³⁺ -ion is een sterk Lewis -zuur. Het hydrolyseert gemakkelijk en brengt een aanzienlijke hoeveelheid H⁺ -ionen vrij, waardoor de oplossing zuur wordt.
4. siliciumtetrachloride (sicl₄): SICL₄ reageert heftig met water en produceert zoutzuur (HCL) en silicinezuur (H₄sio₄). Deze reactie leidt tot een zeer zure oplossing.
5. fosfor -trichloride (PCL₃): PCL₃ reageert met water om fosforzuur (H₃PO₃) en zoutzuur (HCL) te vormen. De resulterende oplossing is zuur.
6. zwavel dichloride (SCL₂): SCL₂ reageert met water om zwavelzuur (H₂so₃) en zoutzuur (HCL) te vormen. De oplossing is zuur.
Key Observations
* zuurgraad neemt van links naar rechts toe: Naarmate u over periode 3 gaat, neemt de zuurgraad van de chloride -oplossingen in het algemeen toe. Dit komt omdat het metalen karakter van de elementen afneemt, wat leidt tot een grotere Lewis -zuurgraad van de metaalkationen en meer krachtige hydrolysereacties met water.
* Niet -metalen chloriden zijn zeer zuur: Niet -metalen chloriden reageren met water om sterke zuren te produceren, wat resulteert in zeer zure oplossingen.
Belangrijke opmerking: De zuurgraad van deze oplossingen hangt af van factoren zoals concentratie en temperatuur. Deze trends bieden een algemeen overzicht.
 Een nieuw materiaal om mechanisch robuuste en vormveranderende structuren te printen
Een nieuw materiaal om mechanisch robuuste en vormveranderende structuren te printen Waarom lost Br2 op in cyclohexaan en niet in water?
Waarom lost Br2 op in cyclohexaan en niet in water?  Kunstmatige antimicrobiële peptiden kunnen helpen om resistente bacteriën te overwinnen
Kunstmatige antimicrobiële peptiden kunnen helpen om resistente bacteriën te overwinnen Hoe maak je uit 37 procent HCL 0,5M HCL?
Hoe maak je uit 37 procent HCL 0,5M HCL?  Hoe standaardiseer je de pH-meter?
Hoe standaardiseer je de pH-meter?
 Milieuministers van G7 komen bijeen om klimaatcrisis te bespreken
Milieuministers van G7 komen bijeen om klimaatcrisis te bespreken Wat voor soort Symmetrie heeft een Hydra?
Wat voor soort Symmetrie heeft een Hydra?  Jongen of meisje? Maki-geuren hebben het antwoord
Jongen of meisje? Maki-geuren hebben het antwoord  In welke situatie is een bos dat het meest waarschijnlijk duurzaam is?
In welke situatie is een bos dat het meest waarschijnlijk duurzaam is?  West-Siberische rivieren en meren stoten broeikasgassen uit in de atmosfeer
West-Siberische rivieren en meren stoten broeikasgassen uit in de atmosfeer
Hoofdlijnen
- Een vaccin voor eetbare planten? nieuwe gewasbeschermingsmethode in zicht
- Hoe interacteren zeevogels uit de Middellandse Zee en de Atlantische Oceaan met de viskwekerijen van vissersvloten?
- Wetenschappers roepen de VS op om onderzoek naar potmedicijnen voor huisdieren toe te staan
- Welke term wordt gedefinieerd als een gedrag of eigenschap van een organisme waardoor het in zijn specifieke omgeving kan overleven?
- Onderwatergeluid beïnvloedt de relaties van zeedieren. Maar in welke mate?
- Moeten astronauten de biologie kennen?
- Genontdekking kan wereldwijde tarwe-epidemie stoppen
- Zijn bacteriën gebaseerd op hun evolutionaire relatie?
- Welke mond is een in spore of hoe kun je omnivore spore zijn?
- Onderzoekers ontwikkelen dubbellaagse verf die warmte reflecteert

- Hoe een bacterie de plasticvervuilingscrisis kan helpen oplossen
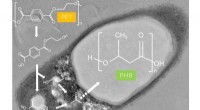
- Enkelkristallijne quaternaire sulfide nanobelts

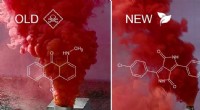
- Een groener alternatief voor roodgekleurde rook
- U uit Minnesota krijgt subsidie om beter plastic op basis van maïs te ontwikkelen

 Wat zijn goede protisten?
Wat zijn goede protisten?  Op welke twee manieren kan de ouderrots het metamorfe proces beïnvloeden?
Op welke twee manieren kan de ouderrots het metamorfe proces beïnvloeden?  Hoe zonnezeilen werken
Hoe zonnezeilen werken  Waarom zouden we fossiele brandstoffen moeten besparen?
Waarom zouden we fossiele brandstoffen moeten besparen?  Is natriumfluoride een moleculaire verbinding?
Is natriumfluoride een moleculaire verbinding?  Is weerstand van de onafhankelijke lading van de geleider?
Is weerstand van de onafhankelijke lading van de geleider?  Wetenschappers onderzoeken een betere manier om waterstof vrij te maken die is opgeslagen in waterstofborideplaten
Wetenschappers onderzoeken een betere manier om waterstof vrij te maken die is opgeslagen in waterstofborideplaten  Wat is het pad van stroomelektriciteit?
Wat is het pad van stroomelektriciteit?
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap © https://nl.scienceaq.com

