
Wetenschap
Hoeveel elektronen verliezen de metalen natriumatomen wanneer ze reageren met een niet -metaal?
Dit is waarom:
* Natrium's elektronenconfiguratie: Natrium heeft een elektronenconfiguratie van 1S²2S²2P⁶3S¹. Het heeft één elektron in zijn buitenste schaal (3S¹).
* De neiging om elektronen te verliezen: Natrium wil een stabiel octet (8 elektronen) bereiken in de buitenste schaal. Het is gemakkelijker voor natrium om zijn enkele valentie -elektron te verliezen dan om er nog zeven te krijgen.
* Vorming van kationen: Door één elektron te verliezen, wordt natrium een positief geladen ion (Na⁺), een kation genoemd.
* reactie met niet -metalen: Niet -metalen daarentegen hebben de neiging elektronen te krijgen om hun octet te voltooien. Wanneer natrium reageert met een niet -metaal, wint de niet -metalen het elektron dat natrium verliest.
Deze overdracht van elektronen vormt een ionische binding, wat leidt tot de vorming van ionische verbindingen.
 Wetenschappers racen om te voorkomen dat de koraalriffen ter wereld verdwijnen
Wetenschappers racen om te voorkomen dat de koraalriffen ter wereld verdwijnen Ontbrekende schakel in algenfotosynthese gevonden, biedt de mogelijkheid om de gewasopbrengst te verbeteren
Ontbrekende schakel in algenfotosynthese gevonden, biedt de mogelijkheid om de gewasopbrengst te verbeteren Brandstofexploratieplannen van $ 5 ton onverenigbaar met klimaatdoelen
Brandstofexploratieplannen van $ 5 ton onverenigbaar met klimaatdoelen Leven onder de oppervlakte in live uitzending
Leven onder de oppervlakte in live uitzending Muziek:Zal de klimaatverandering ons de blues bezorgen?
Muziek:Zal de klimaatverandering ons de blues bezorgen?
Hoofdlijnen
- Waarom analyseren wetenschappers resultaten van experimenten?
- 'Evolutionaire fitheid' speelt een sleutelrol bij het bepalen waarom sommige vrouwen fysiek aantrekkelijker zijn dan andere
- Biosynthetische geheimen:hoe schimmels bioactieve verbindingen maken
- Wat beschrijft correct een verschil tussen de mannelijke en vrouwelijke voortplantingssystemen?
- Waar vindt het gistingsproces plaats in eukaryote cellen?
- Centriole: definitie, functie en structuur
- Nieuw onderzoek laat zien hoe wetenschappers sociale media gebruiken
- Hoe je een groeiende bevolking gezond voedsel kunt geven zonder de planeet te ruïneren
- Hoe virussen werken
- Een doorbraak in onderzoek naar chirale polymere dunne films zou een nieuwe generatie apparaten mogelijk kunnen maken
- Nieuwe MOF is potentiële next-gen halfgeleider
- Duurzame coating doodt het COVID-virus en andere ziektekiemen in enkele minuten

- Snelle urinetest voor amfetaminen stuurt resultaten via app

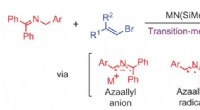
- Overgangsmetaalvrije koolstof-koolstofbindingsvormende reactie:vinylering van azaallyls
 Wat is de hoogte van een cumulonimbus -wolken?
Wat is de hoogte van een cumulonimbus -wolken?  Wat is 170 graden in Celsius?
Wat is 170 graden in Celsius?  UITLEG:Wat maakt zangvogels uit het midden van de Atlantische Oceaan ziek?
UITLEG:Wat maakt zangvogels uit het midden van de Atlantische Oceaan ziek?  Wat maakt een gasoven alleen maar koude lucht blazen?
Wat maakt een gasoven alleen maar koude lucht blazen?  Hoe verhouden drie wetten zich tot lichaamsbeweging?
Hoe verhouden drie wetten zich tot lichaamsbeweging?  Wanneer speelde Georgio Canalia voor de Cosmos?
Wanneer speelde Georgio Canalia voor de Cosmos?  Welke dierentuindieren zijn het meest actief in de winter en op welke tijden kun je ze het beste zien?
Welke dierentuindieren zijn het meest actief in de winter en op welke tijden kun je ze het beste zien?  Wat zijn verstoringen die energie door materie dragen?
Wat zijn verstoringen die energie door materie dragen?
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap © https://nl.scienceaq.com

