
Wetenschap
De gebalanceerde vergelijking is 2NA3N- 6NA plus N2 als 100,0 gram NA3N ontleedt om natrium en stikstof te vormen, hoeveel worden er gevormd?
1. Bereken de molaire massa van Na3n:
* Na (natrium) heeft een molaire massa van 22,99 g/mol
* N (stikstof) heeft een molaire massa van 14,01 g/mol
* Molaire massa van Na3n =(3 * 22,99 g/mol) + (1 * 14.01 g/mol) =82,97 g/mol
2. Bereken de mol na3n:
* Mol =massa / molaire massa
* Mol na3n =100,0 g / 82,97 g / mol =1,207 mol
3. Gebruik de molverhouding van de gebalanceerde vergelijking om mol NA en N2 te vinden:
* Uit de evenwichtige vergelijking:2 mol NA3N → 6 mol Na + 1 mol N2
* Mol na =(1.207 mol NA3N) * (6 mol na / 2 mol NA3N) =3,621 mol na
* Mol n2 =(1.207 mol na3n) * (1 mol n2 / 2 mol na3n) =0,6035 mol n2
4. Bereken de massa van NA en N2 gevormd:
* Massa van Na =mol na * molaire massa van Na
* Massa van NA =3.621 mol * 22,99 g/mol =83,3 g
* Massa van n2 =mol n2 * molaire massa van n2
* Massa van N2 =0,6035 mol * 28,02 g/mol =16,9 g
Daarom:
* 83.3 gram natrium (Na) worden gevormd.
* 16,9 gram stikstof (N2) worden gevormd.
 Grote moleculen uit voedingsvezels kunnen de darmomgeving veranderen door fysieke krachten
Grote moleculen uit voedingsvezels kunnen de darmomgeving veranderen door fysieke krachten Amerikaanse antitrustmaatregelen tegen Amazon? Tot nu toe niet
Amerikaanse antitrustmaatregelen tegen Amazon? Tot nu toe niet  Schudden, rammelaar, en rol naar hoogrenderende fotovoltaïsche energie
Schudden, rammelaar, en rol naar hoogrenderende fotovoltaïsche energie Wat is de massa van chloorgas van 0,560 mol?
Wat is de massa van chloorgas van 0,560 mol?  Wat is de kleinste eenheid van chemische verbinding die nog steeds eigenschappenverbinding heeft?
Wat is de kleinste eenheid van chemische verbinding die nog steeds eigenschappenverbinding heeft?
 Hoe beïnvloedt kooldioxide het milieu?
Hoe beïnvloedt kooldioxide het milieu?  Warmtevasthoudende koolstofdioxide in lucht bereikt nieuw record (update)
Warmtevasthoudende koolstofdioxide in lucht bereikt nieuw record (update) Bruinviskalveren blootgesteld aan neurotoxische PCB's in moedermelk
Bruinviskalveren blootgesteld aan neurotoxische PCB's in moedermelk Stikstof uit antropogene bron domineert in neerslagnitraat
Stikstof uit antropogene bron domineert in neerslagnitraat Wat is een positief en negatief effect van interactie tussen menselijke omgeving?
Wat is een positief en negatief effect van interactie tussen menselijke omgeving?
Hoofdlijnen
- Wat breekt een dubbele DNA-helix uiteen?
- Wat betekent classificeren in wetenschappelijke methode?
- Een parasiet volgen die vissen verwoest
- Het weer in november is een lastige tijd voor schildpadden
- Hoe wordt het genoemd als wetenschappers onderzoeken hoe goed wetenschappers de wetenschappelijke methode volgen?
- Wat moet een wetenschapper doen om te bepalen of de gegevens de hypothese ondersteunen?
- Hoe verschillen bacteriën van dieren- en plantencellen?
- De volgorde van de bases langs een gen bepaalt in welke?
- Welke binding vormt zich tussen tRNA en mRNA?
- Gebruik van metaal-organische kaders om plastic af te breken

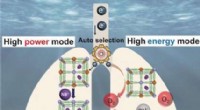
- Energie uit zeewater:stroomgenerator schakelt autonoom tussen twee functionele modi
- Wetenschappers stellen een nieuwe methode voor om gevaarlijke stikstofhoudende vloeistoffen op te sporen
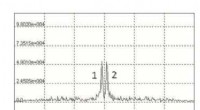
- MOF's kunnen lastige gassen detecteren en sorteren

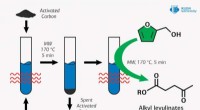
- Chemicus stelt nieuwe manier voor om de brandstofkwaliteit te verbeteren met behulp van microgolfstraling
 Wat is het verschil tussen een spore en coccusvormige bacteriën?
Wat is het verschil tussen een spore en coccusvormige bacteriën?  Hoe wordt sedimenatry rock gevormd?
Hoe wordt sedimenatry rock gevormd?  Welk effect heeft de afvalsenergie van een transformator op lucht rond de?
Welk effect heeft de afvalsenergie van een transformator op lucht rond de?  Op de boerderij? Daar is een app voor
Op de boerderij? Daar is een app voor  Waarom is het moeilijk om een metalen geleider op te laden die met de handen vasthield?
Waarom is het moeilijk om een metalen geleider op te laden die met de handen vasthield?  De rotatie-as van de aarde is gekanteld onder een hoek van 23,5 graden. Welke verandering zou je op aarde zien als deze niet gekanteld was?
De rotatie-as van de aarde is gekanteld onder een hoek van 23,5 graden. Welke verandering zou je op aarde zien als deze niet gekanteld was?  Nanodeeltjes kunnen kubisch groeien
Nanodeeltjes kunnen kubisch groeien Computermodellen vinden oude oplossingen voor moderne problemen
Computermodellen vinden oude oplossingen voor moderne problemen
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap © https://nl.scienceaq.com

