
Wetenschap
Wat is het deeltjesmodel voor ijzer en zwavel in detail?
deeltjesmodel van ijzer en zwavel
Het deeltjesmodel van materie beschrijft materie die bestaat uit kleine deeltjes die constant bewegen en met elkaar inwerken. Hier is een gedetailleerde blik op ijzer en zwavel:
ijzer (Fe)
* atomen: IJzer is een metalen element en de kleinste eenheid is een atoom. Een ijzeratoom bevat 26 protonen, 26 elektronen en 30 neutronen (voor de meest voorkomende isotoop, ijzer-56).
* Structuur: IJzeratomen zijn gerangschikt in een strak verpakt, herhalende, driedimensionale structuur die een lichaamsgericht kubisch rooster wordt genoemd . Deze opstelling geeft ijzer zijn kracht en kneedbaarheid.
* binding: De ijzeratomen worden bij elkaar gehouden door metalen bindingen. Bij metallic binding worden de buitenste elektronen van elk atoom delocaliseerd, wat betekent dat ze vrij zijn om door de hele structuur te bewegen. Dit vrije verkeer van elektronen is wat ijzer de uitstekende geleidbaarheid van warmte en elektriciteit geeft.
* eigenschappen: IJzer is een vaste stof bij kamertemperatuur vanwege de sterke metalen bindingen die zijn atomen bij elkaar houden. Het is een goede geleider van warmte en elektriciteit als gevolg van de gedelocaliseerde elektronen. IJzer is ook relatief dicht en sterk, waardoor het nuttig is voor de bouw en productie.
* staten van materie: IJzer kan bestaan in drie staten:vaste, vloeistof en gas. In de vaste toestand zijn de atomen strak verpakt en trillen in vaste posities. Wanneer ijzer smelt, krijgen de atomen voldoende energie om de aantrekkingskracht tussen hen te overwinnen, waardoor ze vrijer kunnen bewegen en stromen. In de gasvormige toestand zijn de atomen breed op afstand en bewegen willekeurig.
zwavel (s)
* atomen: Zwavel is een niet-metalen element en de kleinste eenheid is een atoom. Een zwavelatoom bevat 16 protonen, 16 elektronen en 16 neutronen.
* Structuur: Zwavelatomen kunnen bestaan in verschillende allotropen, elk met een andere structuur en eigenschappen. De meest voorkomende allotrope bij kamertemperatuur is rhombische zwavel , waar zwavelatomen zijn gerangschikt in een complexe ringstructuur met acht leden.
* binding: Zwavelatomen worden bij elkaar gehouden door covalente bindingen. Bij covalente binding delen atomen elektronen om een stabiele elektronische configuratie te bereiken. In rhombische zwavel vormt elk zwavelatoom twee covalente bindingen met aangrenzende zwavelatomen, waardoor een ringachtige structuur ontstaat.
* eigenschappen: Zwavel is een brosse, gele vaste stof bij kamertemperatuur. Het is een slechte geleider van warmte en elektriciteit omdat zijn elektronen strak zijn gebonden binnen de covalente bindingen. Zwavel is ook relatief zacht en heeft een laag smeltpunt in vergelijking met ijzer.
* staten van materie: Zwavel kan bestaan in alle drie de toestanden:vaste, vloeistof en gas. In de vaste toestand zijn zwavelatomen gerangschikt in een specifieke structuur, zoals hierboven beschreven. Wanneer zwavel smelt, breken de covalente bindingen tussen zwavelatomen en bewegen de atomen vrijer. In de gasvormige toestand bestaat zwavel als diatomaire moleculen (S2).
Belangrijkste verschillen:
* binding: IJzer heeft metaalbinding, terwijl zwavel covalente binding heeft.
* Structuur: IJzer heeft een strak verpakt, herhalende roosterstructuur, terwijl de structuur van Sulphur complexer is en varieert afhankelijk van de allotrope.
* eigenschappen: IJzer is sterk, dicht en geleidend, terwijl zwavel bros, zacht en een slechte geleider is.
Samenvattend:
Het deeltjesmodel helpt ons de eigenschappen van ijzer en zwavel te begrijpen door uit te leggen hoe hun atomen zijn gerangschikt en gebonden. Dit begrip is cruciaal voor verschillende toepassingen in de wetenschap, engineering en het dagelijks leven.
 Eta brengt zware regens, dodelijke modderstromen naar Honduras
Eta brengt zware regens, dodelijke modderstromen naar Honduras Wetenschappers reageren op kritiek op voorgesteld Antropoceen
Wetenschappers reageren op kritiek op voorgesteld Antropoceen Hoe monarchvlinders zijn bedraad voor navigatie
Hoe monarchvlinders zijn bedraad voor navigatie  Een nieuwe cycloon doemt op voor India, week na dodelijke storm
Een nieuwe cycloon doemt op voor India, week na dodelijke storm Nieuwe studie identificeert de samenstelling van organische stof als een kritische factor die de methylering van kwik controleert
Nieuwe studie identificeert de samenstelling van organische stof als een kritische factor die de methylering van kwik controleert
Hoofdlijnen
- Welk proces produceert klonen?
- Onderzoekers ontdekken hoe en waar borsttumorcellen inactief worden, waardoor ze uitzaaien
- Hoe menselijke eieren eindigen met het verkeerde aantal chromosomen
- In het moderne classificatiesysteem zijn drie domeinen?
- Studie helpt verklaren hoe de C. elegans-worm draait
- Wat is de samenstellende vorm van AB?
- Waarom de wetenschap niet helpt bij het verkopen van chocoladekoekjes
- Waarom de suikerkorrels een monster van de materie zijn. Welke reden?
- Wat is totaal RNA?
- Onstabiele molecuulklikken met synthetische strategie
- Loden leidingen veilig maken

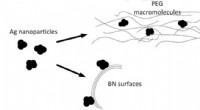
- Boornitride en zilveren nanodeeltjes om de uitstoot van koolmonoxide te verminderen
- Koolstofvezels van groene voorlopers en geoptimaliseerde processen

- Het verminderen van vallen verhoogt de prestaties van organische fotodetectoren

 Wat is de chemische formule voor cupric sulfide?
Wat is de chemische formule voor cupric sulfide?  Wat betekent een troost van sterren?
Wat betekent een troost van sterren?  Wetenschappers leerden fluorescentiemicroscoop om zich automatisch aan te passen aan elk monster
Wetenschappers leerden fluorescentiemicroscoop om zich automatisch aan te passen aan elk monster Wat zijn de doelen van door de mens gemaakte rotsformaties?
Wat zijn de doelen van door de mens gemaakte rotsformaties?  Hoe wordt achtergrondstraling veroorzaakt door rotsen grond en kosmische stralen?
Hoe wordt achtergrondstraling veroorzaakt door rotsen grond en kosmische stralen?  Welke kleur op de ph-schaal toont sterke zuren?
Welke kleur op de ph-schaal toont sterke zuren?  Onderzoekers bereiken ongekende controle over polymeerroosters
Onderzoekers bereiken ongekende controle over polymeerroosters Welke vorm is de zon aarde en andere planeten?
Welke vorm is de zon aarde en andere planeten?
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap © https://nl.scienceaq.com

