
Wetenschap
Is fluor een veel sterker oxidatiemiddel dan zuurstof?
* elektronegativiteit: Fluor is het meest elektronegatieve element op het periodiek systeem. Dit betekent dat het een veel sterkere aantrekkingskracht heeft op elektronen dan zuurstof.
* Elektronenaffiniteit: Fluor heeft een hogere elektronenaffiniteit dan zuurstof, wat betekent dat het meer energie vrijgeeft wanneer het een elektron krijgt.
* bindingssterkte: De F-F-binding in fluorgas is zwakker dan de O-O-binding in zuurstofgas. Dit maakt fluor waarschijnlijker om zijn binding te verbreken en te reageren met andere stoffen om een elektron te krijgen.
In eenvoudige bewoordingen: Fluor is zo enthousiast om een elektron te krijgen om zijn buitenste schaal te voltooien dat het elektronen gemakkelijk weg van andere elementen zal trekken, waardoor ze in het proces worden geoxideerd.
Voorbeelden:
* Fluor kan water oxideren, zuurstof en hydrofluorzuur produceren.
* Fluor kan reageren met edelgassen zoals Xenon om verbindingen zoals XEF2 en XEF4 te vormen. Deze reacties zijn uiterst moeilijk te bereiken met zuurstof.
Opmerking: Hoewel fluor een zeer sterk oxidatiemiddel is, is het belangrijk om te onthouden dat zowel zuurstof als fluor als oxidatoren kunnen werken, afhankelijk van de specifieke chemische reactie.
Hoofdlijnen
- Welk type RNA kopieert DNA -instructies op de kern?
- Een protist die zijn eigen voedsel maakt, is een?
- Type evolutie waarin niet -gerelateerde organismen onafhankelijk overeenkomsten evolueren bij het aanpassen aan vergelijkbare omgevingen?
- Naam 3 Gistgedrag op basis van moderne concepten van microbieel metabolisme?
- Het verschil tussen een sporofyt en gametofyt
- Protisten hebben wat intermediaire mitotische organisatie wordt genoemd. Wat is de meest waarschijnlijke hypothese over deze vormen van celdeling?
- Wetenschappers ontwikkelen nieuwe aanpak om belangrijke onontdekte functies van eiwitten te identificeren
- Deze ringstaartmaki's veroorzaken een stank als ze flirten met potentiële partners
- Wat is een markermolecuul?
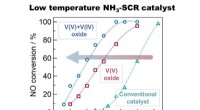
- Nieuwe katalysatoren verwijderen stikstofoxideverontreinigende stoffen bij lagere temperaturen
- Vormverschuivende protocellen duiden op de mechanica van het vroege leven

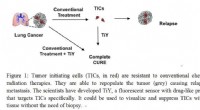
- Veelzijdige sensor tegen tumor-initiërende cellen
- Fossiele brandstoffen kunnen nog steeds bijdragen aan luchtvervuiling, zelfs als de auto is uitgeschakeld

- Periodiek systeem ontdekt in St. Andrews erkend als oudste ter wereld

 Wat is de snelheid van een bewegend object met KE 50 J massa .5 kg?
Wat is de snelheid van een bewegend object met KE 50 J massa .5 kg?  Kwantumsprong in computergebruik terwijl Google suprematie claimt (update)
Kwantumsprong in computergebruik terwijl Google suprematie claimt (update) Staten die de zwaartekracht tussen twee objecten dwingen toeneemt met de massa object?
Staten die de zwaartekracht tussen twee objecten dwingen toeneemt met de massa object?  Wat is de Hz -frequentie van de aarde?
Wat is de Hz -frequentie van de aarde?  Waarom zijn korstersoorten hoger in koelere habitats?
Waarom zijn korstersoorten hoger in koelere habitats?  Sociale media voor seksuele voorlichting:Zuid-Afrikaanse tieners leggen uit hoe het hen zou helpen
Sociale media voor seksuele voorlichting:Zuid-Afrikaanse tieners leggen uit hoe het hen zou helpen  Reizen radiogolven en licht op dezelfde snelheid?
Reizen radiogolven en licht op dezelfde snelheid?  Waar bevindt zich een Nimbus -wolk aan de hemel?
Waar bevindt zich een Nimbus -wolk aan de hemel?
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap © https://nl.scienceaq.com


