
Wetenschap
Uit ethanol en butanol die meer oplosbaar is in water?
Verklaring:
Oplosbaarheid in water hangt af van het vermogen van een stof om waterstofbruggen te vormen met watermoleculen.
* ethanol (CH3CH2OH) Heeft een kleinere koolwaterstofketen in vergelijking met butanol, waardoor het meer polair is en waardoor het sterkere waterstofbindingen met water kan vormen.
* butanol (CH3CH2CH2CH2OH) Heeft een langere koolwaterstofketen, waardoor het minder polair is en zijn vermogen om waterstofbruggen met water te vormen, wordt verminderd.
Als gevolg hiervan heeft ethanol een hogere oplosbaarheid in water dan butanol.
Oplosbaarheid in water:
* ethanol: Mengbaar (oneindig oplosbaar)
* butanol: Enigszins oplosbaar
Belangrijke factoren die de oplosbaarheid beïnvloeden:
* polariteit: Polaire verbindingen zijn meer oplosbaar in polaire oplosmiddelen zoals water.
* waterstofbinding: Het vermogen om waterstofbindingen te vormen, verhoogt de oplosbaarheid in water.
* Grootte van de koolwaterstofketen: Grotere koolwaterstofketens verminderen de polariteit en verminderen de oplosbaarheid.
 Welke elementen zijn vloeistoffen op 30 graden Celsius?
Welke elementen zijn vloeistoffen op 30 graden Celsius?  Is koolstofdioxide gemaakt van zuurstof?
Is koolstofdioxide gemaakt van zuurstof?  Als chloorgas door een waterige oplossing van natriumjodide wordt geborreld, wat heeft er dan een elementaire jodium en chloride op?
Als chloorgas door een waterige oplossing van natriumjodide wordt geborreld, wat heeft er dan een elementaire jodium en chloride op?  Rol van mierenzuur in verfafbijtmiddel?
Rol van mierenzuur in verfafbijtmiddel?  Wat is de chemische formule voor ontbijtgranen?
Wat is de chemische formule voor ontbijtgranen?
 Hoe lang duurt het voordat zeegras zich herstelt? Wat meer zwanen zouden estuarium-ecosystemen kunnen betekenen
Hoe lang duurt het voordat zeegras zich herstelt? Wat meer zwanen zouden estuarium-ecosystemen kunnen betekenen  Brandende zomers worden het nieuwe normaal in Europa:studeren
Brandende zomers worden het nieuwe normaal in Europa:studeren In het drukke orkaanseizoen 2020 zet Louisiana zich voor de 6e keer schrap
In het drukke orkaanseizoen 2020 zet Louisiana zich voor de 6e keer schrap Kunnen brandganzen het klimaat voorspellen?
Kunnen brandganzen het klimaat voorspellen?  Welke extreme brandseizoenen en 2500 jaar bosgeschiedenis ons vertellen over de toekomstige bosbranden in West-Europa
Welke extreme brandseizoenen en 2500 jaar bosgeschiedenis ons vertellen over de toekomstige bosbranden in West-Europa
Hoofdlijnen
- Wat is een homologe expressiesysteem?
- Wat heeft de walvissen gedood? Twee dood aangetroffen bij de Florida Keys en één naar een jachthaven gesleept
- Nieuwe functie in genregulerend eiwit ontdekt
- Drie hoofdafdelingen van de hersenen?
- Wie heeft klonen bedacht en wanneer?
- Hoe vormen wetenschapper hypothese?
- Aziatische bossen tonen veerkracht ondanks toenemende verstoringen als gevolg van klimaatverandering en menselijke activiteiten
- Wat betekent de medische term Beroep en woning van parasieten op het externe huidoppervlak?
- Bevat multicellulair organisme triljoenen cellen?
- Wetenschappers stellen methode voor om de efficiëntie van zonnebatterijen te verhogen
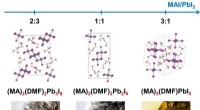
- Ingenieurs gebruiken grafieknetwerken om eigenschappen van moleculen en kristallen nauwkeurig te voorspellen
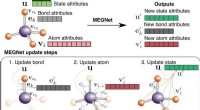
- Ionisch defectlandschap in perovskiet-zonnecellen onthuld

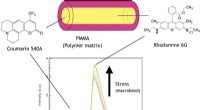
- Op polymeer gebaseerde optische vezel voor visualisatie van materiaalspanning
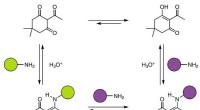
- Chemici maken thermohardend polymeer met behulp van amine en triketon dat recyclebaar is
 Hogere werkloosheid en minder inkomen:hoe huiselijk geweld vrouwen financieel kost
Hogere werkloosheid en minder inkomen:hoe huiselijk geweld vrouwen financieel kost  Lijst met insecten die dood vlees eten
Lijst met insecten die dood vlees eten  Waarom buigen de meeste vaste stoffen?
Waarom buigen de meeste vaste stoffen?  Wat is de definitie van reproductief vermogen?
Wat is de definitie van reproductief vermogen?  Hoe wordt de meeste thermische energie in de atmosfeer overgedragen?
Hoe wordt de meeste thermische energie in de atmosfeer overgedragen?  Lucas sluit een lamp aan in de muur. De gloeilamp om bochten. Wat voor soort energietransformatie is dit?
Lucas sluit een lamp aan in de muur. De gloeilamp om bochten. Wat voor soort energietransformatie is dit?  Wat is de gereduceerde zwaveltest?
Wat is de gereduceerde zwaveltest?  Wat zijn drie van aardes speren waarin energie wordt overgedragen door convectie?
Wat zijn drie van aardes speren waarin energie wordt overgedragen door convectie?
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap © https://nl.scienceaq.com

