
Wetenschap
Waarom is een waterige oplossing van kopersulfaat zuur van aard?
1. Koper (II) Ionhydrolyse:
* Wanneer kopersulfaat oplost in water, dissocieert het in koper (II) ionen (Cu²⁺) en sulfaationen (SO₄²⁻).
* Koper (II) ionen zijn klein en zeer opgeladen, waardoor ze sterk polariserend zijn. Dit betekent dat ze elektronendichtheid aantrekken en trekken uit de zuurstofatomen in watermoleculen.
* Deze interactie verzwakt de O-H-bindingen in watermoleculen, waardoor het gemakkelijker is voor de waterstofionen (H⁺) om te dissociëren.
* De volgende evenwichtsreactie treedt op:
`` `
Cu²⁺ (aq) + 2h₂o (l) ⇌ [cu (h₂o) ₄] ²⁺ (aq) + h⁺ (aq)
`` `
2. Verhoging van waterstofionconcentratie:
* De hydrolysereactie produceert waterstofionen (H⁺), die de concentratie van H⁺ in de oplossing verhoogt.
* Omdat pH een maat is voor de concentratie waterstofionen, resulteert een hogere concentratie van H⁺ in een lagere pH -waarde.
3. Zure aard:
* Een lagere pH -waarde geeft de zuurgraad aan. Daarom maakt de aanwezigheid van overtollige waterstofionen (H⁺) in de oplossing als gevolg van de hydrolyse van het koper (II) -ion de waterige oplossing van kopersulfaatzuur.
Samenvattend: De zuurgraad van een kopersulfaatoplossing komt voort uit de hydrolyse van het koper (II) ion, wat leidt tot de afgifte van waterstofionen en een lagere pH.
 Welk subatomaire deeltje bepaalt de naam van een atoom?
Welk subatomaire deeltje bepaalt de naam van een atoom?  Aangezien een zure oplossing wordt toegevoegd aan een basis, de pH van afname?
Aangezien een zure oplossing wordt toegevoegd aan een basis, de pH van afname?  Wereldprimeur voor het lezen van digitaal gecodeerde synthetische moleculen
Wereldprimeur voor het lezen van digitaal gecodeerde synthetische moleculen Zijn er niet -voorbeelden van radioactief verval?
Zijn er niet -voorbeelden van radioactief verval?  Een pH van wordt als neutraal beschouwd.?
Een pH van wordt als neutraal beschouwd.?
 Wat zou er met het klimaat gebeuren als we de hele tropen zouden herbebossen?
Wat zou er met het klimaat gebeuren als we de hele tropen zouden herbebossen? Peruaanse boer boekt kleine overwinning in rechtbank op Duitse energiegigant
Peruaanse boer boekt kleine overwinning in rechtbank op Duitse energiegigant Het 'paranooteffect' helpt verklaren hoe rivieren erosie weerstaan, vindt het team
Het 'paranooteffect' helpt verklaren hoe rivieren erosie weerstaan, vindt het team  Vroege COVID-19-lockdowns hadden minder impact op de stedelijke luchtkwaliteit dan eerst werd gedacht
Vroege COVID-19-lockdowns hadden minder impact op de stedelijke luchtkwaliteit dan eerst werd gedacht Sommige Texanen trotseren evacuatie, thuis stormen
Sommige Texanen trotseren evacuatie, thuis stormen
Hoofdlijnen
- Hoe symbiose werkt
- Wat komt er na een organen?
- Wat zijn de natuurlijke componenten van lucht?
- Waar komen de ingrediënten in dat broodje vandaan? Onze wereldwijde nutriëntentracker vertelt een complex verhaal
- Het specifieke gehoororgaan wordt genoemd?
- Zijn algen abiotische factoren of biotische factoren?
- Welke zoogdieren overwinteren?
- Een onderzoek laat zien hoe ademhalingsbuizen en haarvaten ontstaan
- Als twee chromosomen dezelfde genen hebben voor eigenschap, wordt gezegd dat ze zijn?
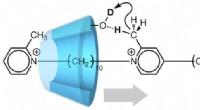
- Moleculaire machine maakt gebruik van beweging in één richting
- Koolstofopname neemt de vorm aan van een spons met een nieuwe, kosteneffectieve methode
- Het mengen van kunstmatige zoetstoffen remt de bittere smaakreceptoren

- Wetenschappers werpen licht op nieuw goedkoop materiaal om in het donker te zien

- Actie van geneesmiddelverbindingen in weefsel onthuld door nieuwe techniek
 Hoeveel pond is gelijk aan 900 kg?
Hoeveel pond is gelijk aan 900 kg?  Wat is hete gloeiende rots die stroomt op het kussen van gassen?
Wat is hete gloeiende rots die stroomt op het kussen van gassen?  Wat is de tempruter in Uranus?
Wat is de tempruter in Uranus?  Afbeelding:sneeuwval met meereffect in de Grote Meren en New York
Afbeelding:sneeuwval met meereffect in de Grote Meren en New York Welk medium reizen mechanische golven het snelst door?
Welk medium reizen mechanische golven het snelst door?  Kan energie van een of andere vorm worden omgezet?
Kan energie van een of andere vorm worden omgezet?  Wetenschappers maken vanadium tot een bruikbare katalysator voor hydrogenering
Wetenschappers maken vanadium tot een bruikbare katalysator voor hydrogenering Sauropod-zwemmers of wandelaars?
Sauropod-zwemmers of wandelaars?
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap © https://nl.scienceaq.com

