
Wetenschap
Hoeveel bindingen vormen stikstof?
Dit is waarom:
* valentie -elektronen: Stikstof heeft 5 valentie -elektronen (elektronen in de buitenste schaal).
* octetregel: Atomen hebben de neiging om elektronen te winnen, verliezen of delen om een stabiel octet (8 elektronen) in hun buitenste schaal te bereiken.
* binding: Om een octet te bereiken, moet stikstof nog drie elektronen krijgen. Het kan dit doen door drie covalente bindingen te vormen en de ene elektron van elke binding met een ander atoom te delen.
Voorbeelden:
* ammoniak (NH3): Stikstof vormt drie enkele bindingen met drie waterstofatomen.
* stikstofoxide (nee): Stikstof vormt een dubbele binding met zuurstof. Een van de bindingen is een coördinaatcovalente binding, waarbij stikstof beide elektronen doneert om de binding te vormen.
Hoewel stikstof typisch drie bindingen vormt, kan het soms vier bindingen vormen in speciale gevallen zoals ammoniumionen (NH4+). Dit komt echter minder vaak voor.
 Model:Hoe ziet het toegenomen gebruik van houtachtige biomassa eruit voor het mondiale bosecosysteem
Model:Hoe ziet het toegenomen gebruik van houtachtige biomassa eruit voor het mondiale bosecosysteem  Hoe menselijke urine de bodemgezondheid en waterkwaliteit kan verstoren
Hoe menselijke urine de bodemgezondheid en waterkwaliteit kan verstoren  Massa's kraaien verspreiden zich C. jejuni:zijn mensen kwetsbaar?
Massa's kraaien verspreiden zich C. jejuni:zijn mensen kwetsbaar?  58 dood, Reddingswerkers gaan dag en nacht op zoek naar vermisten na tyfoon in Japan
58 dood, Reddingswerkers gaan dag en nacht op zoek naar vermisten na tyfoon in Japan Waarom bewegen wortels van de planten altijd naar de aarde?
Waarom bewegen wortels van de planten altijd naar de aarde?
Hoofdlijnen
- Is algen een consument of producent?
- Komt glycolyse op binnen of buiten de mitochondria?
- Roodbuikmaki's behouden de darmgezondheid door elkaar aan te raken en tegen elkaar aan te kruipen
- Genontdekking kan wereldwijde tarwe-epidemie stoppen
- Waarom zijn zaadbanken nodig? | Hoe dingen werken
- Zijn de hersenen van de Hobbit onhaalbaar klein?
- Wie doet wat op Wikipedia?
- Regenboogkleuren onthullen celgeschiedenis
- Honden snuffelden vroeger aan zeldzame soorten
- Een geoptimaliseerde structuur van memristive-apparaat voor neuromorfe computersystemen
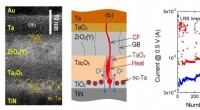
- Een methode voor computerondersteunde modellering en simulatie van grote eiwitten en andere biomoleculen

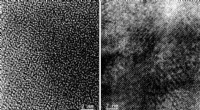
- Wetenschappers gebruiken nieuwe methode om veelbelovend batterijmateriaal te maken
- Nieuw metamateriaal verandert in nieuwe vormen, nieuwe panden aannemen

- Fluorescentiepatronen helpen bij medische diagnostiek

 Wat laat de zon en de maan schijnen?
Wat laat de zon en de maan schijnen?  De netto kracht die op een stationair object werkt, is nul die de snelheid het beste beschrijft?
De netto kracht die op een stationair object werkt, is nul die de snelheid het beste beschrijft?  Hoe de luchtdruk in een huis te verhogen
Hoe de luchtdruk in een huis te verhogen  Welke vloeistof stop je in een beker?
Welke vloeistof stop je in een beker?  Kunstmatige intelligentie kan privégegevens in gevaar brengen
Kunstmatige intelligentie kan privégegevens in gevaar brengen Enorme ringachtige structuur op het oppervlak van Ganymedes is mogelijk veroorzaakt door een gewelddadige impact (update)
Enorme ringachtige structuur op het oppervlak van Ganymedes is mogelijk veroorzaakt door een gewelddadige impact (update) Lichtmeting maakt een schatting van de chemische eigenschappen van kruidenextracten mogelijk
Lichtmeting maakt een schatting van de chemische eigenschappen van kruidenextracten mogelijk  Hoe bacteriën wondgenezing ondersteunen
Hoe bacteriën wondgenezing ondersteunen
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap © https://nl.scienceaq.com

