
Wetenschap
Wat zie je als je kaliumchloride oplost met water?
* ontbinding: De ionische bindingen houden het kalium (k+) en chloride (Cl-) ionen samen in de vaste KCL-kristalbreuk. De watermoleculen, die polair zijn, omringen de ionen en trekken ze uit elkaar en scheiden ze effectief van het kristalrooster.
* Oplossing: De kalium- en chloride -ionen worden omgeven door watermoleculen en vormen een homogeen mengsel (oplossing). De oplossing lijkt helder en kleurloos, vergelijkbaar met zuiver water.
belangrijke opmerkingen:
* Warmteverandering: Het oplossen van KCL in water is een endotherme proces, wat betekent dat het warmte van de omgeving absorbeert. Misschien merk je een licht koeleffect als je een grote hoeveelheid KCL oplost.
* Geen zichtbaar neerslag: Omdat kaliumchloride zeer oplosbaar is in water, ziet u geen vaste neerslagvorming.
Kortom, de meest opvallende verandering bij het oplossen van KCL in water is de verdwijning van de vaste kristallen, wat resulteert in een heldere, kleurloze oplossing.
 Chemici verrassende ontdekking van nano-beperkte reacties kunnen helpen bij katalytisch ontwerp
Chemici verrassende ontdekking van nano-beperkte reacties kunnen helpen bij katalytisch ontwerp Welk mengsel gemaakt door een vloeistof en gas te mengen?
Welk mengsel gemaakt door een vloeistof en gas te mengen?  Hoeveel mol zitten er in 2,3 x 1023 formule-eenheden NaCl?
Hoeveel mol zitten er in 2,3 x 1023 formule-eenheden NaCl?  Wanneer substantie veranderingen vormt, wat gebeurt er met de dichtheid?
Wanneer substantie veranderingen vormt, wat gebeurt er met de dichtheid?  Hoeveel elektronen zijn er in de buitenste valentieschil van een zwavelatoom?
Hoeveel elektronen zijn er in de buitenste valentieschil van een zwavelatoom?
 Wereldwaterdag 2020:ontziltingstechnologieën zorgen voor veilig en duurzaam drinkwater
Wereldwaterdag 2020:ontziltingstechnologieën zorgen voor veilig en duurzaam drinkwater Instrumenten voor aardobservatie slagen voor beoordeling
Instrumenten voor aardobservatie slagen voor beoordeling Wat is het verschil tussen licht en duisternis?
Wat is het verschil tussen licht en duisternis?  'Eat, Poop, Die':het boek van een onderzoeker onderzoekt hoe dieren onze wereld maken
'Eat, Poop, Die':het boek van een onderzoeker onderzoekt hoe dieren onze wereld maken  Kijk eerst naar een duurzame landbouwmulch
Kijk eerst naar een duurzame landbouwmulch
Hoofdlijnen
- Welk type macromolecuul fungeert als een identificatiemarkering?
- Waar in het lichaam is vitamine D geproduceerd en uit welk molecuul wordt het gewijzigd?
- Welk systeem is verantwoordelijk voor de vorming van spijsverteringsenzymen?
- Wat zijn mitochondria niet gevonden?
- Nieuwe techniek kan verband aantonen tussen prooidieren en microplastics
- Welke is geen discipline van anatomie?
- Wat bevat eiwitten?
- Onderzoekers meten de bereidheid van kleinschalige vissers om vaartuigvolgsystemen te gebruiken
- Wat zijn drie bewijsstukken die de evolutie van de theorie ondersteunen?
- De beweging van fluorescerende sondes door het celmembraan stimuleren
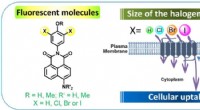
- Onderzoekers maken nieuw laagsmeltend, stikstofhoudend, tinachtig chloorfosfaatglas

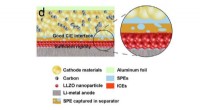
- Onderzoekers ontwerpen dendrietvrije lithiumbatterij
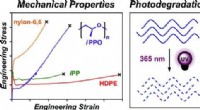
- Chemici maken sneller afbreekbaar plastic voor gebruik op zee
- Wetenschappers ontdekken nieuwe niet-kleverige gels

 Welke eenheid wordt gebruikt om de afstand tussen hemellichamen te meten?
Welke eenheid wordt gebruikt om de afstand tussen hemellichamen te meten?  Een nieuwe manier om met zonlicht schone waterstofbrandstof te maken uit water
Een nieuwe manier om met zonlicht schone waterstofbrandstof te maken uit water Wat is de polariteit van auto's van de auto?
Wat is de polariteit van auto's van de auto?  Wat zijn enkele nadelen aan het gebruik van windenergie -energie?
Wat zijn enkele nadelen aan het gebruik van windenergie -energie?  De lichtsnelheid is 3,00 welke gelijk is aan wat?
De lichtsnelheid is 3,00 welke gelijk is aan wat?  Overschakelen naar een thuisbatterij zal de wereld niet redden van klimaatverandering
Overschakelen naar een thuisbatterij zal de wereld niet redden van klimaatverandering Wat is gemaakt van koper?
Wat is gemaakt van koper?  Wat is de oorzaak van bewegingselektronen?
Wat is de oorzaak van bewegingselektronen?
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap © https://nl.scienceaq.com

