
Wetenschap
Waarom is koper meer metaalachtig dan in theorie zou moeten zijn?
* Wat betekent "metallic"? Het metalen karakter van een element verwijst naar zijn neiging om elektronen te verliezen en positieve ionen (kationen) te vormen. Dit wordt beïnvloed door factoren zoals ionisatie -energie, elektronenaffiniteit en elektronegativiteit.
* het verwachte gedrag van koper: Koper is een overgangsmetaal, wat betekent dat het een gedeeltelijk gevulde d orbitaal heeft. Overgangsmetalen vertonen over het algemeen een reeks metalen eigenschappen. Vooral koper staat bekend om zijn uitstekende elektrische geleidbaarheid en kneedbaarheid, die typerend zijn voor metaalgedrag.
* Geen tegenstrijdigheid: De eigenschappen van Copper komen goed overeen met zijn positie in de periodiek systeem en de elektronenconfiguratie. Er is geen theoretische reden dat het "meer metaalachtig" is dan verwacht.
Mogelijke verwarring: Misschien denk je aan het ongewone gedrag van Copper in bepaalde situaties, zoals:
* Ongewone oxidatie staat: Koper kan ionen vormen met verschillende oxidatietoestanden (bijv. Cu+ en Cu2+). Dit komt door de complexe interacties van zijn D -elektronen.
* kleur: De roodbruine kleur van Copper is niet typerend voor de meeste metalen, die meestal zilver of grijsachtig zijn. Dit komt door de absorptie van licht in het zichtbare spectrum door koper.
Conclusie: Het metalen karakter van Copper wordt goed onderzocht door zijn elektronische structuur en positie op het periodiek systeem. Het vertoont geen ongebruikelijk "meer metallisch" gedrag dat in tegenspraak is met theoretische verwachtingen.
 Brandend probleem:branden in Indonesië zetten palmolie onder de loep
Brandend probleem:branden in Indonesië zetten palmolie onder de loep Is in een onveranderlijke selectie van het milieu in een goed aangepaste bevolking?
Is in een onveranderlijke selectie van het milieu in een goed aangepaste bevolking?  Lijst van de Top Tien Bedreigde Dieren
Lijst van de Top Tien Bedreigde Dieren  Feiten over witte eiken bomen
Feiten over witte eiken bomen  Nieuwe studie suggereert dat de koolstofput op het land in de VS mogelijk is overschat
Nieuwe studie suggereert dat de koolstofput op het land in de VS mogelijk is overschat
Hoofdlijnen
- Is een kristal abiotisch of biotisch?
- Welk molecuul wordt gebruikt om celmembraan te vormen?
- Waarom is stikstof belangrijk voor planten?
- Wat zijn enkele nadelen van de hermafrodietstaat bij dieren?
- Life Sciences is de studie van?
- Wat zijn de drie macromoleculen die uw lichaam nodig heeft voor een goede voeding?
- Wat doen chloroplastes en chlorophll?
- Hoe de hoed past:onderzoek naar structurele biologie onthult de vorm van het epigenetische enzymcomplex
- Twee soorten fagocyten
- Anti-verouderingsmolecuul NAD+ krijgt een boost door het blokkeren van een enzym
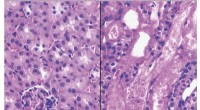
- Nieuwe studie kijkt naar biologische enzymen als bron van waterstofbrandstof

- Door nieuwe technologie kunnen belangrijke metalen efficiënter worden gemaakt

- NIST breidt database uit die helpt bij het identificeren van onbekende verbindingen in melk
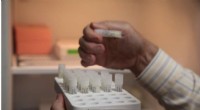
- Biopolymeren voor wondtherapie leveren stamcellen om de genezing te verbeteren
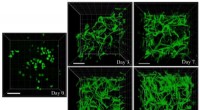
 Is water dat op een fornuis kookt chemisch?
Is water dat op een fornuis kookt chemisch?  Wat zijn de effecten van het verbranden van fossielen op de wereld?
Wat zijn de effecten van het verbranden van fossielen op de wereld?  Wanneer de invallende hoek gelijk is aan kritiek, dan is wat van breking?
Wanneer de invallende hoek gelijk is aan kritiek, dan is wat van breking?  Hoe dik is de continentale korst van de aarde in km?
Hoe dik is de continentale korst van de aarde in km?  Mag formaldehyde tegenwoordig als ontsmettingsmiddel worden gebruikt?
Mag formaldehyde tegenwoordig als ontsmettingsmiddel worden gebruikt?  Hoe te zien of een object zal zinken of dobberen
Hoe te zien of een object zal zinken of dobberen Hoe zijn nucleaire brandstoffen in stroomstations om elektriciteit te genereren?
Hoe zijn nucleaire brandstoffen in stroomstations om elektriciteit te genereren?  Nieuwe goedkope tactiele sensor laat robots voelen
Nieuwe goedkope tactiele sensor laat robots voelen
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap © https://nl.scienceaq.com

