
Wetenschap
Welke massa CCL4 wordt gevormd door de reactie van 8,00 g methaan met een overtollig chloride?
1. Schrijf de gebalanceerde chemische vergelijking:
Ch₄ + 4cl₂ → CCL₄ + 4HCl
2. Bereken de molaire methaanmassa (ch₄):
* C:12.01 g/mol
* H:1.01 g/mol
* Molaire massa van ch₄ =12.01 + (4 * 1.01) =16,05 g/mol
3. Bereken de mol methaan:
* Mol =massa / molaire massa
* Mol ch₄ =8,00 g / 16,05 g / mol =0,498 mol
4. Gebruik de molverhouding van de gebalanceerde vergelijking:
* De gebalanceerde vergelijking toont een 1:1 molverhouding tussen CH₄ en CCL₄. Dit betekent dat voor elke 1 mol CH₄ reageerde, 1 mol CCL₄ wordt geproduceerd.
5. Bereken de mol CCl₄ gevormd:
* Mol ccl₄ =0,498 mol
6. Bereken de molaire massa van CCL₄:
* C:12.01 g/mol
* CL:35.45 g/mol
* Molaire massa van CCL₄ =12.01 + (4 * 35.45) =153,81 g/mol
7. Bereken de massa van CCL₄ gevormd CCL₄:
* Massa =mollen * molaire massa
* Massa van CCL₄ =0.498 mol * 153,81 g/mol = 76,7 g
Daarom wordt 76,7 g CCL₄ gevormd door de reactie.
 Wat is de set verklaringen of principes die worden gebruikt om een groepsfeiten te verklaren die natuurfenomenen is?
Wat is de set verklaringen of principes die worden gebruikt om een groepsfeiten te verklaren die natuurfenomenen is?  Noodopstijging van oceaanmissies veroorzaakt door motorbrand
Noodopstijging van oceaanmissies veroorzaakt door motorbrand Onderzoekers weggeblazen door orkaansimulatie
Onderzoekers weggeblazen door orkaansimulatie NASA ziet post-tropische cycloon Lorenzo Ierland treffen
NASA ziet post-tropische cycloon Lorenzo Ierland treffen Overgang naar hernieuwbare energie moet rekening houden met de wereldwijde bedreiging voor soorten
Overgang naar hernieuwbare energie moet rekening houden met de wereldwijde bedreiging voor soorten
Hoofdlijnen
- Welke organel in plantencel breekt suikers af voor cellulaire energie?
- Hoe lang voedt een walvis zich? Nieuwe data geven inzicht in blauw- en vingedrag
- Ziekte van Lyme bij honden:wat hondeneigenaren moeten weten
- Hoe zijn de hersenen van primaten zo groot geworden?
- Welk soort zuur zit er in een aardappel?
- Onderzoekers helpen migrerende zalm de hotspot van sterfte te overleven
- Europarlementariërs dringen aan op onderzoek naar Monsantos heerschappij over veiligheidsstudies
- Twee groepen prokaryoten die hun eigen voedsel maken van anorganische moleculen zijn?
- Is evolutie voorspelbaar?
- De eigen assemblagelijn van de natuur verkennen

- Ontwerpstrategie op moleculair niveau kan de sleutel zijn tot het stimuleren van commerciële waterstofproductie
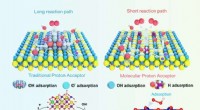
- Een Tootsie Roll-sensor likken om de gezondheid te controleren

- Klaar voor de zomerzon met groene zonneschermen
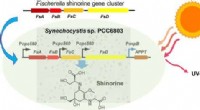
- Hoe een biofysische simulatiemethode het ontdekken van medicijndoelen kan versnellen?
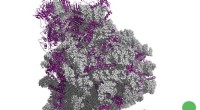
 NASA vindt tropische cycloon Luban kruipend
NASA vindt tropische cycloon Luban kruipend Wat zijn geheugen T -cellen?
Wat zijn geheugen T -cellen?  Hoeveel energie gebruikt een persoon in het jaar?
Hoeveel energie gebruikt een persoon in het jaar?  Omzet Alibaba stijgt in eerste kwartaal
Omzet Alibaba stijgt in eerste kwartaal Hoe zijn zowel luchtweerstand als wrijving?
Hoe zijn zowel luchtweerstand als wrijving?  Op nanovezels gebaseerde wondverbanden induceren de productie van antimicrobieel peptide
Op nanovezels gebaseerde wondverbanden induceren de productie van antimicrobieel peptide Peptiden op interstellair ijs:Uit onderzoek blijkt dat de aanwezigheid van watermoleculen geen groot obstakel is voor vorming
Peptiden op interstellair ijs:Uit onderzoek blijkt dat de aanwezigheid van watermoleculen geen groot obstakel is voor vorming  Welke van deze zou u verwachten dat u de meeste kracht vergroten die een kleine massa of afnemende massa vergroten?
Welke van deze zou u verwachten dat u de meeste kracht vergroten die een kleine massa of afnemende massa vergroten?
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap © https://nl.scienceaq.com

