
Wetenschap
Kunnen alle isotopen van een element van hetzelfde type ionen?
* isotopen: Isotopen van een element hebben hetzelfde aantal protonen (atoomnummer) maar verschillende aantallen neutronen. Dit betekent dat ze hetzelfde aantal elektronen in hun neutrale toestand hebben, maar hun massagummers verschillen.
* ionisatie: Ionisatie omvat de winst of verlies van elektronen. De neiging van een atoom om een specifiek ion te vormen wordt grotendeels bepaald door de elektronenconfiguratie, met name het aantal valentie -elektronen (elektronen in de buitenste schaal).
* Elektronenconfiguratie: Hoewel isotopen dezelfde elektronenconfiguratie in hun neutrale toestand hebben, kan de aanwezigheid van verschillende aantallen neutronen subtiel de stabiliteit van de kern beïnvloeden en bijgevolg de energieniveaus van de elektronen. Dit verschil kan soms leiden tot variaties in het gemak waarmee een isotoop elektronen verliest of wint.
Voorbeeld:
* carbon-12 (¹²C) en carbon-14 (¹⁴C) zijn beide isotopen van koolstof.
* ¹²C is de meest voorkomende isotoop en vormt gemakkelijk een +4 kation (C⁴⁺) in verbindingen.
* ¹⁴C , hoewel nog steeds koolstof, kan iets ander ionisatiegedrag vertonen vanwege de aanwezigheid van twee extra neutronen. Hoewel het nog steeds kationen kan vormen, kan de neiging om dit te doen enigszins anders zijn.
Samenvattend:
Hoewel isotopen van een element dezelfde chemische eigenschappen delen als gevolg van hetzelfde aantal protonen en elektronen, kunnen de subtiele nucleaire verschillen die worden geïntroduceerd door variërende neutronenaantallen soms hun ionisatietesensies beïnvloeden. Dit betekent dat hoewel de meeste isotopen dezelfde soorten ionen zullen vormen, er subtiele variaties kunnen zijn in hun ionisatiegedrag.
 Wat is de reactie tussen natriumhydroxide en calciumbicarbonaat?
Wat is de reactie tussen natriumhydroxide en calciumbicarbonaat?  Laboratoriumgegevens geven aan dat een verbinding is samengesteld uit 43,3 procent natrium 11,3 koolstof en 45,3 zuurstof Hoeveel gram kan elk element worden verondersteld te presenteren?
Laboratoriumgegevens geven aan dat een verbinding is samengesteld uit 43,3 procent natrium 11,3 koolstof en 45,3 zuurstof Hoeveel gram kan elk element worden verondersteld te presenteren?  Wat is de kleur van Iron III sulfaatoplossing?
Wat is de kleur van Iron III sulfaatoplossing?  Hoe gedraagt koolstofdioxide zich als een giftig gas?
Hoe gedraagt koolstofdioxide zich als een giftig gas?  Wat is de Noble-Gas-notatie van Tungsten?
Wat is de Noble-Gas-notatie van Tungsten?
Hoofdlijnen
- Nieuw onderzoek biedt inzicht in hoe het leven zich kan aanpassen en mogelijk opnieuw kan worden uitgevonden
- Het verschil tussen craniologie en frenologie
- Wat doet microtublues?
- Welke organel in een autotrofe eukaryotische cel gevonden?
- Wat zijn de belangrijkste functies van Cilia & Flagella?
- Wetenschappers tonen aan dat ribosomen een onverwachte rol spelen bij de vorming van bloedvaten
- De Stoned Ape-hypothese:hebben paddo's de menselijke evolutie beïnvloed?
- Welke staten dat fossiele organismen elkaar in een duidelijke en bepalbare volgorde opvolgen?
- Hoe agro-ecologie onderdeel kan zijn van een ‘rechtvaardige transitie’ voor het Canadese voedselsysteem
- Ziekteverwekkers te slim af zijn - onderzoek is bedoeld om de belangrijkste uitdagingen op het gebied van waterfiltratie op te lossen

- Hoe de topologie van een poreus materiaal de fasescheiding van binaire mengsels beïnvloedt

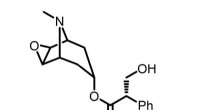
- Onderzoekers melden volledig synthetische route naar scopolamine, middel tegen misselijkheid
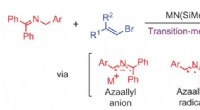
- Overgangsmetaalvrije koolstof-koolstofbindingsvormende reactie:vinylering van azaallyls
- Nieuwe verbinding kan voorkomen dat bacteriën ziekte veroorzaken

 Hoe groeit uw tuin?
Hoe groeit uw tuin?  Wat zijn enkele voorbeelden van de geologische erosie?
Wat zijn enkele voorbeelden van de geologische erosie?  Boventonen kunnen zorgen voor snellere datacommunicatie
Boventonen kunnen zorgen voor snellere datacommunicatie Welke twee vormen van energie produceren een gloeilamp?
Welke twee vormen van energie produceren een gloeilamp?  Nieuwe med-tech zinksensor ontwikkeld
Nieuwe med-tech zinksensor ontwikkeld Alibaba-inkomsten stijgen met 61%, maar eenmalige kosten drukken winst
Alibaba-inkomsten stijgen met 61%, maar eenmalige kosten drukken winst Wat is een bioscientist?
Wat is een bioscientist?  Luister, reageer, zeg sorry:klanten die eten bezorgen laten zien hoe ze het direct na een storing kunnen oplossen
Luister, reageer, zeg sorry:klanten die eten bezorgen laten zien hoe ze het direct na een storing kunnen oplossen
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap © https://nl.scienceaq.com

