
Wetenschap
Waarom NaCl is ionische verbinding terwijl chloorgascovalente verbinding?
ionische verbindingen:
* Formatie: Ionische verbindingen vormen zich wanneer een metaal (zoals natrium, NA) elektronen verliest om een positief geladen ion (kation) te worden en een niet -metaal (zoals chloor, CL) elektronen laat een negatief geladen ion worden (anion). De elektrostatische aantrekkingskracht tussen de tegengesteld geladen ionen houdt de verbinding bij elkaar.
* NaCl: Natrium (NA) verliest gemakkelijk één elektron om een stabiele elektronenconfiguratie te bereiken en wordt NA⁺. Chloor (CL) krijgt gemakkelijk één elektron om een stabiele elektronenconfiguratie te bereiken, en wordt CL⁻. Deze tegengesteld geladen ionen trekken sterk aan en vormen het ionische samengestelde natriumchloride (NaCl).
Covalente verbindingen:
* Formatie: Covalente verbindingen vormen zich wanneer twee niet -metalen elektronen delen om een stabiele elektronenconfiguratie te bereiken.
* Cl₂: Chloor is een niet -metaal. In chloorgas (CL₂) hebben twee chlooratomen elk zeven valentie -elektronen. Om stabiliteit te bereiken, delen ze elk één elektron en vormen ze een covalente binding.
Belangrijkste verschillen:
* elektronegativiteit: Metalen hebben een lage elektronegativiteit (aantrekkingskracht voor elektronen), terwijl niet -metalen een hoge elektronegativiteit hebben. In ionische verbindingen is het verschil in elektronegativiteit groot, wat leidt tot een volledige overdracht van elektronen. In covalente verbindingen is het elektronegativiteitsverschil kleiner, wat resulteert in elektronenuitwisseling.
* Bondtype: Ionische verbindingen worden bij elkaar gehouden door elektrostatische aantrekkingskracht tussen ionen. Covalente verbindingen worden bij elkaar gehouden door het delen van elektronenparen.
* eigenschappen: Ionische verbindingen hebben meestal hoge smeltpunten, hoge kookpunten en zijn vaak oplosbaar in water. Covalente verbindingen hebben over het algemeen lagere smeltpunten en kookpunten en zijn vaak onoplosbaar in water.
Samenvattend: Het verschil in bindingstype tussen NaCl en CL₂ komt voort uit de elektronegativiteitsverschillen tussen de betrokken elementen. NaCl omvat een metaal (natrium) en een niet -metaal (chloor), wat leidt tot ionische binding. CL₂ omvat twee niet -metalen (chloor), wat leidt tot covalente binding.
 Is de opwarming van het noordpoolgebied achter een monsterlijke stofstorm uit de Sahara?
Is de opwarming van het noordpoolgebied achter een monsterlijke stofstorm uit de Sahara? Visserij in Tasmanië gekookt door recordbrekende hittegolf op zee
Visserij in Tasmanië gekookt door recordbrekende hittegolf op zee De geheimen van de oceanen ontsluiten:technologie van de volgende generatie voor nauwkeurig in kaart brengen van de zeebodem
De geheimen van de oceanen ontsluiten:technologie van de volgende generatie voor nauwkeurig in kaart brengen van de zeebodem  Wat gebeurt er met fruit dat op de grond landt in regenwoud?
Wat gebeurt er met fruit dat op de grond landt in regenwoud?  NASA begint met het laatste ijsonderzoek in de lucht
NASA begint met het laatste ijsonderzoek in de lucht
Hoofdlijnen
- Wat is de kleinste rattensoort?
- Wat is de functie van cubidoiaal epitheel?
- Wat zou er met een eiwit gebeuren als het gen van DNA zou worden veranderd?
- Welke structuur is betrokken bij eukaryote celdeling?
- Uit de kleine teelballen van vliegen ontstaat nieuw inzicht in hoe genen ontstaan
- Waar wordt Myelin gevonden en wat zijn functie?
- Wat is de eerste waarneembare verandering in een cel die begint met splijting?
- Hoe ver reizen invasieve soorten?
- Welke lichaamssystemen zijn betrokken bij de ademhaling?
- Levens-emulerende moleculen vertonen een basismetabolisme
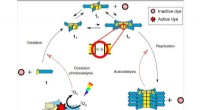
- Onderzoekers lossen een 50 jaar oud enzymmysterie op
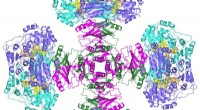
- Iridium-gekatalyseerde waterstofadditie, natuurlijke stoffen op basis van planten en insecten geven

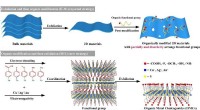
- 2-D geordende organische metaalchalcogeniden ontwikkeld met breed afstembare elektronische bandhiaten
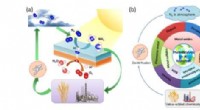
- Fotochemische stikstoffixatie - nieuwe perspectieven openen voor een toekomst met duurzame energie
 Wanneer water door pijpen mag stromen, creëert dit wat voor soort energie?
Wanneer water door pijpen mag stromen, creëert dit wat voor soort energie?  Regeling voor duurzame gecertificeerde palmolie haalt doelen niet
Regeling voor duurzame gecertificeerde palmolie haalt doelen niet Wat heeft het universum geïoniseerd?
Wat heeft het universum geïoniseerd? Is polyethyleen een vaste vloeistof of gas bij kamertemperatuur?
Is polyethyleen een vaste vloeistof of gas bij kamertemperatuur?  Team ontwikkelt gevoelige nieuwe manier om transistordefecten te detecteren
Team ontwikkelt gevoelige nieuwe manier om transistordefecten te detecteren Is het waar dat de eerste wet van de bewegingswet stelt dat een object in rust de neiging heeft om te blijven en dat een verblijf met kracht gelijk is aan zijn stuwkracht?
Is het waar dat de eerste wet van de bewegingswet stelt dat een object in rust de neiging heeft om te blijven en dat een verblijf met kracht gelijk is aan zijn stuwkracht?  Waarom is het zo moeilijk om de afhankelijkheid van benzine te verminderen?
Waarom is het zo moeilijk om de afhankelijkheid van benzine te verminderen?  Een onderwijspsycholoog legt uit hoe u over uw ATAR kunt nadenken en naschoolse doelen kunt stellen
Een onderwijspsycholoog legt uit hoe u over uw ATAR kunt nadenken en naschoolse doelen kunt stellen
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap © https://nl.scienceaq.com

