
Wetenschap
Wat is een belangrijke toepassing van waterstofbinding?
* Eigenschappen van het water: Waterstofbindingen tussen watermoleculen geven water zijn unieke eigenschappen:
* Hoog kookpunt: Water heeft een relatief hoog kookpunt vanwege de sterke waterstofbruggen die moeten worden verbroken om het te verdampen. Hierdoor kan het leven bestaan in vloeibaar water.
* Hoge oppervlaktespanning: Waterstofbinding creëert een sterke samenhangende kracht tussen watermoleculen, waardoor water een hoge oppervlaktespanning geeft. Dit is cruciaal voor veel biologische processen, zoals de beweging van water door planten.
* Uitstekend oplosmiddel: Met de polariteit van het water kan het veel ionische en polaire verbindingen oplossen, waardoor het een uitstekend oplosmiddel is voor biologische moleculen.
* eiwitstructuur: Waterstofbindingen zijn essentieel voor het handhaven van de secundaire en tertiaire structuren van eiwitten. Ze helpen de polypeptideketens in de juiste vorm te houden, waardoor eiwitten goed kunnen functioneren.
* DNA -structuur: Waterstofbindingen houden de twee DNA -strengen bij elkaar en vormen de dubbele helix. Met deze bindingen kan DNA nauwkeurig worden gerepliceerd en getranscribeerd, essentieel voor het leven.
* interacties tussen enzym-substraat: Waterstofbindingen spelen een cruciale rol bij de vorming van enzym-substraatcomplexen. Met deze bindingen kunnen enzymen hun specifieke substraten herkennen en binden, waardoor biochemische reacties worden vergemakkelijkt.
Naast deze biologische toepassingen speelt waterstofbinding ook een belangrijke rol in:
* chemie: Waterstofbindingen zijn belangrijk voor de eigenschappen van veel organische moleculen, zoals alcoholen en carbonzuren.
* Materialenwetenschap: Waterstofbinding wordt gebruikt bij de synthese van materialen met specifieke eigenschappen, zoals polymeren en biocompatibele materialen.
Over het algemeen is waterstofbinding een alomtegenwoordige kracht in de natuur, met diepgaande implicaties voor veel gebieden van wetenschap en technologie. Het belang ervan in de biologie alleen maakt het een kritische factor voor het leven op aarde.
 Zijn jodiumkristallen polair of niet polair?
Zijn jodiumkristallen polair of niet polair?  Onderzoekers ontwikkelen materialen om geneesmiddelen uit afvalwater te verwijderen
Onderzoekers ontwikkelen materialen om geneesmiddelen uit afvalwater te verwijderen Hoe vind je het aantal protonen uit het atoomnummer?
Hoe vind je het aantal protonen uit het atoomnummer?  Verandert stikstof van vloeistof naar gas bij dezelfde temperatuur Welk water verandert vloeistofgas?
Verandert stikstof van vloeistof naar gas bij dezelfde temperatuur Welk water verandert vloeistofgas?  Oplosbaarheidsmysterie van veelgebruikt plastic opgelost
Oplosbaarheidsmysterie van veelgebruikt plastic opgelost
 Onderzoekers ontwikkelen nieuw EcoCity-model om stedelijke hitte-eilanden te verminderen
Onderzoekers ontwikkelen nieuw EcoCity-model om stedelijke hitte-eilanden te verminderen Wat is een bepaalde rol in een ecosysteem of hoe het zijn leven verdient?
Wat is een bepaalde rol in een ecosysteem of hoe het zijn leven verdient?  Waarom ecologisch herstel zonder inheems leiderschap geen stand zal houden
Waarom ecologisch herstel zonder inheems leiderschap geen stand zal houden  Hoe groeit uw groene daktuin?
Hoe groeit uw groene daktuin?  Het leven in het water:waarom kikkersoorten overdag genen hielden die aangepast waren aan nachtzicht
Het leven in het water:waarom kikkersoorten overdag genen hielden die aangepast waren aan nachtzicht
Hoofdlijnen
- Wat is een hypothesen?
- Hoe verklaren basenparingsregels hoe een DNA-streng tijdens replicatie als sjabloon fungeert?
- Waar komen Australische katten vandaan?
- Organisme: definitie, types, kenmerken en voorbeelden
- Onderzoek werpt licht op hoe antibiotica klittenband bacteriën doodt
- Hoe algenbiodiesel werkt
- Hoe worden eukaryotische organismen geclassificeerd op de boom van het leven door hun fysieke kenmerken of genetische samenstelling b.v. DNA en RNA?
- Welke epitheliale weefsels vormt de opperhuid van de huid?
- Waarom zijn er geen Eenhoorns?
- Wetenschappers ontwikkelen duurzame manier om chitine uit garnalenschelpen te extraheren door het te vergisten met fruitafval

- Cantharelpaddestoelen als smaakversterker

- Op de natuur geïnspireerde antibacteriële metalen

- Aromaatiteit in katalyse begrijpen om nieuwe kansen te ontsluiten
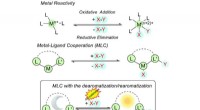
- Onderzoekers maken alcohol uit het niets
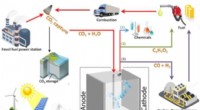
 Wat gebeurt er met het snelheidslicht als het een ander medium binnengaat?
Wat gebeurt er met het snelheidslicht als het een ander medium binnengaat?  Wat is een verandering in de vorm van golffront?
Wat is een verandering in de vorm van golffront?  AI gebruiken om oorzakelijke verbanden in overlappende medische datasets te ontdekken
AI gebruiken om oorzakelijke verbanden in overlappende medische datasets te ontdekken Brian woont in een bioom dat erg lijkt op graslandbomen die het landschap hiervan spotten, dit heeft seizoensgebonden regens en blijft het hele jaar door warm wat voor soort is waarschijnlijk L?
Brian woont in een bioom dat erg lijkt op graslandbomen die het landschap hiervan spotten, dit heeft seizoensgebonden regens en blijft het hele jaar door warm wat voor soort is waarschijnlijk L?  Abiotische factoren in een aquatisch ecosysteem
Abiotische factoren in een aquatisch ecosysteem  Experimentele tests van relativistische chemie zullen het periodiek systeem bijwerken
Experimentele tests van relativistische chemie zullen het periodiek systeem bijwerken Door de staat gestuurde emissiecontroles slechts iets duurder
Door de staat gestuurde emissiecontroles slechts iets duurder Wat kan er met een organisme gebeuren als het orgaansysteem niet goed functioneert?
Wat kan er met een organisme gebeuren als het orgaansysteem niet goed functioneert?
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap © https://nl.scienceaq.com

