
Wetenschap
Wat is de theoretische opbrengst van aluminiumoxide als 2,20 metaal wordt blootgesteld aan 1,95 zuurstof?
1. Schrijf de gebalanceerde chemische vergelijking:
4 AL + 3 O₂ → 2 Al₂o₃
2. Converteer de massa's reactanten in mollen:
* aluminium (AL):
* Molaire massa van Al =26,98 g/mol
* Mol AL =2,20 g / 26,98 g / mol =0,0815 mol
* zuurstof (o₂):
* Molaire massa van O₂ =32,00 g/mol
* Mol O₂ =1,95 g / 32,00 g / mol =0,0609 mol
3. Bepaal de beperkende reactant:
* met behulp van de molverhouding van de gebalanceerde vergelijking:
* 4 mol AL reageert met 3 mol O₂
* Bereken de mol O₂ die nodig is om te reageren met de gegeven mol al:
* (0,0815 mol AL) * (3 mol O₂ / 4 mol Al) =0,0611 mol O₂
* Omdat we slechts 0,0609 mol O₂ hebben, is zuurstof de beperkende reactant.
4. Bereken de mol aluminiumoxide (al₂o₃) geproduceerd:
* met behulp van de molverhouding van de gebalanceerde vergelijking:
* 3 mol O₂ produceert 2 mol al₂o₃
* Bereken de mol van al₂o₃ geproduceerde:
* (0,0609 mol o₂) * (2 mol al₂o₃ / 3 mol o₂) =0,0406 mol al₂o₃
5. Converteer mol al₂o₃ naar gram (theoretische opbrengst):
* Molaire massa van al₂o₃ =101,96 g/mol
* theoretische opbrengst:
* (0,0406 mol al₂o₃) * (101,96 g/mol) = 4,15 g al₂o₃
Daarom is de theoretische opbrengst van aluminiumoxide 4,15 gram.
 Wat is de chemische vergelijking van C3H8?
Wat is de chemische vergelijking van C3H8?  Wat is de reactie tussen methanol en ethaanzuur?
Wat is de reactie tussen methanol en ethaanzuur?  Is het water H8O of H2O?
Is het water H8O of H2O?  Een oplossing bevat 1,20 g CACL2 en 240 ml Wat is de percentage W-W-concentratie als een dichtheid 1,13 g-ml heeft?
Een oplossing bevat 1,20 g CACL2 en 240 ml Wat is de percentage W-W-concentratie als een dichtheid 1,13 g-ml heeft?  Hoe kan de massa van een atoom van periodiek worden weergegeven met betrekking tot mol?
Hoe kan de massa van een atoom van periodiek worden weergegeven met betrekking tot mol?
 Welk dier leeft in een boomgat het regenwoud?
Welk dier leeft in een boomgat het regenwoud?  Hoe u uw tuinvogels kunt voeren als u inheemse soorten wilt aantrekken en ondersteunen
Hoe u uw tuinvogels kunt voeren als u inheemse soorten wilt aantrekken en ondersteunen  Een boom planten en de aarde redden?
Een boom planten en de aarde redden?  Waarom mijden kleine plattelandsgemeenschappen nieuwkomers vaak, zelfs als ze ze nodig hebben?
Waarom mijden kleine plattelandsgemeenschappen nieuwkomers vaak, zelfs als ze ze nodig hebben?  Wetenschappers waarschuwen voor onnoemelijk lijden in klimaatnoodtoestand
Wetenschappers waarschuwen voor onnoemelijk lijden in klimaatnoodtoestand
Hoofdlijnen
- Wetenschappers geloven dat evolutie koraalriffen kan redden, als we het toestaan
- Hoeveel chromosomen zitten er in een shiitake -paddestoelcel?
- Wat is een computersoftwareprogramma dat bestaat uit cellen met rijen en colums?
- Welk element uit groep 5a, behalve stikstof, is essentieel voor levende organismen?
- Wat zijn larvale voedselplanten?
- Honingbijen steken minder snel in grotere groepen
- Hoe je hersenen werken
- Wat is het voordeel van aseksuele sporen?
- Welke organel die alle celfuncties beheert of regelt in een eukaryotische cel?
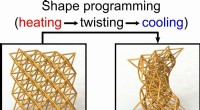
- 4D-geprinte materialen kunnen zo stijf zijn als hout of zacht als een spons
- Niet-gechloreerde, met oplosmiddel verwerkte hoogwaardige ambipolaire transistors

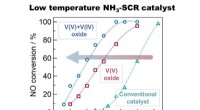
- Nieuwe katalysatoren verwijderen stikstofoxideverontreinigende stoffen bij lagere temperaturen
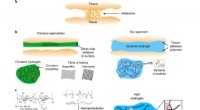
- Onderzoekers creëren een effectievere hydrogel voor het genezen van wonden

- Onderzoekers ontdekken dat gel littekenweefsel vermindert na operatie bij dieren
 Het voordeel testen van linkshandig zijn in de sport
Het voordeel testen van linkshandig zijn in de sport Wat is F het volgende, geen belangrijk onderdeel van magma?
Wat is F het volgende, geen belangrijk onderdeel van magma?  Afbeelding:Chaos bij Hyperion
Afbeelding:Chaos bij Hyperion Olie en het noordpoolgebied:wat staat er op het spel
Olie en het noordpoolgebied:wat staat er op het spel Verspreidt trillingen of golf zich door de ruimte?
Verspreidt trillingen of golf zich door de ruimte?  Thorium supergeleiding:wetenschappers ontdekken nieuwe hoge-temperatuur supergeleider
Thorium supergeleiding:wetenschappers ontdekken nieuwe hoge-temperatuur supergeleider Wat is de enige vloeistof in groep 17 van periodieke grafiek?
Wat is de enige vloeistof in groep 17 van periodieke grafiek?  Hoe werken glow-in-the-dark dingen?
Hoe werken glow-in-the-dark dingen?
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap © https://nl.scienceaq.com

