
Wetenschap
Wat is er betrokken bij een chemische reactie?
1. Reactanten:
* Dit zijn de startmaterialen in een chemische reactie.
* Zij zijn de stoffen die een chemische verandering ondergaan.
* Ze hebben specifieke chemische formules en eigenschappen.
2. Producten:
* Dit zijn de stoffen gevormd als gevolg van de chemische reactie.
* Ze hebben verschillende chemische formules en eigenschappen dan de reactanten.
3. Chemische bindingen:
* Chemische reacties omvatten het breken en vormen van chemische bindingen tussen atomen.
* Bindingen houden atomen bij elkaar in moleculen.
* Het breken en vormen van bindingen omvat energieveranderingen.
4. Energieveranderingen:
* Chemische reacties kunnen energie vrijgeven of absorberen.
* exotherme reacties Maak energie vrij, vaak in de vorm van warmte of licht.
* Endotherme reacties energie absorberen uit hun omgeving.
5. Reactieomstandigheden:
* Chemische reacties vereisen vaak dat specifieke omstandigheden optreden, zoals:
* Temperatuur: Hogere temperaturen versnellen vaak reacties.
* Druk: Veranderingen in druk kunnen de snelheid van gasfase-reacties beïnvloeden.
* concentratie: De hoeveelheid reactanten kan de reactiesnelheid beïnvloeden.
* katalysator: Een katalysator versnelt een reactie zonder zichzelf te worden geconsumeerd.
6. Reactiemechanismen:
* Dit is de stapsgewijze reeks gebeurtenissen die optreden tijdens een reactie.
* Het beschrijft de tussenproducten en overgangstoestanden die bij het proces betrokken zijn.
7. Chemische vergelijkingen:
* Chemische reacties worden weergegeven met behulp van chemische vergelijkingen.
* Deze vergelijkingen tonen de reactanten aan de linkerkant en de producten aan de rechterkant, met pijlen die de richting van de reactie aangeven.
* Coëfficiënten voor de chemische formules geven het aantal mol van elke betrokken stof aan.
Key Concepts:
* Behoud van massa: In een chemische reactie moet de totale massa van de reactanten gelijk zijn aan de totale massa van de producten.
* Conservering van energie: Energie kan niet worden gecreëerd of vernietigd, alleen van de ene vorm naar de andere worden getransformeerd.
* evenwicht: Veel chemische reacties zijn omkeerbaar, wat betekent dat ze in zowel voorwaartse als omgekeerde richtingen kunnen doorgaan. Evenwicht wordt bereikt wanneer de snelheden van de voorwaartse en omgekeerde reacties gelijk zijn.
Voorbeelden van chemische reacties:
* verbranding: Het branden van brandstof, zoals hout of propaan, laat warmte en licht vrij.
* fotosynthese: Planten gebruiken zonlicht, koolstofdioxide en water om glucose en zuurstof te produceren.
* roesten: IJzer reageert met zuurstof en water om ijzeroxide (roest) te vormen.
Inzicht in de concepten die betrokken zijn bij chemische reacties is van fundamenteel belang voor de chemie en speelt een cruciale rol op verschillende gebieden, waaronder geneeskunde, landbouw en materiaalwetenschap.
 Hoe beïnvloedt klimaatverandering de biodiversiteit?
Hoe beïnvloedt klimaatverandering de biodiversiteit?  Bosherstel in Zuid-Oregon kan voorrang hebben op leefgebied van gevlekte uilen
Bosherstel in Zuid-Oregon kan voorrang hebben op leefgebied van gevlekte uilen Onderzoekers volgen nutriëntentransport in de Golf van Mexico
Onderzoekers volgen nutriëntentransport in de Golf van Mexico NASA-campagne in de lucht vangt de drift van sneeuwwater
NASA-campagne in de lucht vangt de drift van sneeuwwater Eens in je leven overstromingen worden tegen het einde van de eeuw een normaal verschijnsel
Eens in je leven overstromingen worden tegen het einde van de eeuw een normaal verschijnsel
Hoofdlijnen
- Hoe verschilt rectus abdominus bij mensen van katten?
- Studie legt uit hoe Enceladus deeltjes uit oceanen onder het oppervlak werpt
- Wat is wetenschappelijke hypothesen?
- Vijf redenen om de insecten in je tuin niet te besproeien
- Hoe verbeteren aanpassingen het overleven van een soort?
- Wat is consumenten Eubacteria?
- Dynamische informatie verkrijgen uit statische snapshots
- Anatomische structuren: homoloog, analoog & vestigiaal
- Hoe ondersteunt genetische variatie de natuurlijke selectie?
- De geheimen achter een griezelige fotografische techniek

- Moleculaire containers voor de sekwestratie van neurotransmittergeneesmiddelen in water
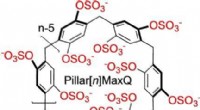
- Chemici laten zien dat zijn heup vierkant is
- Video:Waar zijn eye crusties van gemaakt?

- Wetenschappers vereenvoudigen het proces om polymeren te maken met door licht geactiveerde nanodeeltjes

 Uit onderzoek blijkt dat celkannibalisme en aanverwante verschijnselen in de levensboom wijdverbreid zijn
Uit onderzoek blijkt dat celkannibalisme en aanverwante verschijnselen in de levensboom wijdverbreid zijn  Grafieken van bloedtestresultaten
Grafieken van bloedtestresultaten  Nieuw onderzoek naar de sterkte van de botten van kinderen kan helpen bij het ontwerpen van veiligere autostoeltjes
Nieuw onderzoek naar de sterkte van de botten van kinderen kan helpen bij het ontwerpen van veiligere autostoeltjes Opinie:Hoe de flessenwaterindustrie de mondiale crisis maskeert
Opinie:Hoe de flessenwaterindustrie de mondiale crisis maskeert  Mede-oprichter van Backpage.com vrijgelaten uit de gevangenis op een borgsom van $ 1 miljoen
Mede-oprichter van Backpage.com vrijgelaten uit de gevangenis op een borgsom van $ 1 miljoen Wetenschappers ontdekken hoe ze kankercellen kunnen misleiden om giftige medicijnen te consumeren
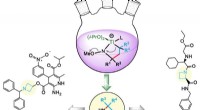
Wetenschappers ontdekken hoe ze kankercellen kunnen misleiden om giftige medicijnen te consumeren Klein volume, organische synthese met hoge doorvoer
Klein volume, organische synthese met hoge doorvoer Welke protist heeft een kern?
Welke protist heeft een kern?
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap © https://nl.scienceaq.com

