
Wetenschap
Waarom heeft chlooroxide een laag smeltpunt?
Laten we echter analyseren waarom * vergelijkbare * verbindingen, zoals Cl₂o, lage smeltpunten hebben:
* Zwakke intermoleculaire krachten: Cl₂o is een covalent molecuul met een relatief laag molecuulgewicht. De primaire intermoleculaire krachten die cl₂o -moleculen aan elkaar houden, zijn zwakke van der Waals -krachten. Deze krachten worden gemakkelijk overwonnen door thermische energie, wat resulteert in een laag smeltpunt.
* polariteit: Hoewel Cl₂o een polair molecuul is, is het dipoolmoment relatief klein. Dit betekent dat de elektrostatische attracties tussen moleculen zwakker zijn dan in zeer polaire verbindingen, wat verder bijdraagt aan een laag smeltpunt.
* Structuur: De structuur van CL₂O is gebogen, wat leidt tot zwakkere intermoleculaire interacties dan in lineaire of meer symmetrische moleculen.
Samenvattend: De combinatie van zwakke intermoleculaire krachten, laag molecuulgewicht en relatief klein dipoolmoment resulteert in een laag smeltpunt voor cl₂o.
Houd er rekening mee dat Clo een radicaal is en geen gedefinieerd smeltpunt heeft.
 De krachten van elektrochemie en stromingstechnologie samenbrengen
De krachten van elektrochemie en stromingstechnologie samenbrengen Is water polairder dan methanol?
Is water polairder dan methanol?  Meerlagige fabricage op wafelschaal van micro-elektronica op basis van zijdefibroïne
Meerlagige fabricage op wafelschaal van micro-elektronica op basis van zijdefibroïne Magnetische effecten aan de oorsprong van het leven? Het is de draai die het verschil maakt
Magnetische effecten aan de oorsprong van het leven? Het is de draai die het verschil maakt  Het produceren van ammoniak via elektrochemische processen kan de uitstoot van kooldioxide verminderen
Het produceren van ammoniak via elektrochemische processen kan de uitstoot van kooldioxide verminderen
 China's afvalverbod zet Amerikaanse recycling op z'n kop - is het tijd om verbranding te heroverwegen?
China's afvalverbod zet Amerikaanse recycling op z'n kop - is het tijd om verbranding te heroverwegen? Wat is een voorbeelduniversum?
Wat is een voorbeelduniversum?  Welke effecten hebben chloorfluorkoolstoffen op de mens?
Welke effecten hebben chloorfluorkoolstoffen op de mens?  COVID-19 is een generale repetitie voor ondernemende benaderingen van klimaatverandering
COVID-19 is een generale repetitie voor ondernemende benaderingen van klimaatverandering Waarschuwingssysteem voor aardbevingen aan de westkust nu operationeel, met limieten
Waarschuwingssysteem voor aardbevingen aan de westkust nu operationeel, met limieten
Hoofdlijnen
- Wie de eerste wetenschapper?
- Waarom gebruikte Mendel alle hoge planten in zijn F1 -experiment?
- Over leverfuncties in het menselijk lichaam
- Wat is er in sociologie?
- Onderzoekers creëren een nauwkeuriger model van hoe sommige microben naar voedingsstoffen zoeken
- Waarom kameleontongen werken in de kou (met video)
- De kleinste en meest voorkomende vorm van prokaryoten die DNA -ribosomen een flagellum cobosomen cobosomen?
- Welke cel kan een stof transporteren als deze te groot is om membraan te kruisen?
- Hoe schakelen gewas-veeteeltsystemen over naar groene landbouwontwikkeling in het Baiyangdian Basin?
- Nieuwe katalysator verhoogt de elektroreductie van kooldioxide tot multicarbon-producten
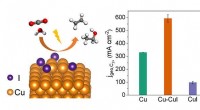
- Onderzoek onthult het corrosiemechanisme van magnesiumlegeringen in een atmosferische mariene omgeving

- Groene waterstof:focus op het katalysatoroppervlak

- Door polyurethaan afbreekbaar te maken, krijgen de componenten een tweede leven

- Wetenschappers bouwen microporeuze MOF-vallen voor het verminderen van giftige gassen
 Welke energietransformaties van een kaars branden?
Welke energietransformaties van een kaars branden?  Nieuwe plasmonische thermische materialen voor zonne-energie ontwikkeld om zonnewarmte te behouden
Nieuwe plasmonische thermische materialen voor zonne-energie ontwikkeld om zonnewarmte te behouden  All-you-can-eat stortplaatsbuffet zorgt voor problemen voor vogels
All-you-can-eat stortplaatsbuffet zorgt voor problemen voor vogels Beschrijf wat er gebeurt met zonne -energie die de aarde bereikt?
Beschrijf wat er gebeurt met zonne -energie die de aarde bereikt?  Kunnen objecten gelijke snelheden hebben zonder snelheid?
Kunnen objecten gelijke snelheden hebben zonder snelheid?  Alle lichaamsorganen zijn van vitaal belang voor het leven of onwaar?
Alle lichaamsorganen zijn van vitaal belang voor het leven of onwaar?  Welke invloed heeft sneeuw op de hoeveelheid water in rivieren?
Welke invloed heeft sneeuw op de hoeveelheid water in rivieren?  Wat wordt gebruikt als een sjabloon voor replicatie?
Wat wordt gebruikt als een sjabloon voor replicatie?
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap © https://nl.scienceaq.com

