
Wetenschap
Is een reactieve vloeistof niet elektriciteit met valentie 1 in zijn verbinding?
* reactieve vloeistof: Dit vertelt ons dat de stof chemisch actief is, wat betekent dat het gemakkelijk deelneemt aan chemische reacties.
* leidt geen elektriciteit: Dit geeft aan dat de stof een niet-elektrolyt is. Niet-elektrolyten hebben geen vrij bewegende ionen (geladen deeltjes) in oplossing, die nodig zijn voor elektrische geleidbaarheid.
* Valentie 1 in zijn verbinding: Valentie verwijst naar de combinatiecapaciteit van een element. Een valentie van 1 betekent dat een element één chemische binding kan vormen.
Hier is het probleem:
* Niet-elektrolyten vormen over het algemeen geen ionische verbindingen. Ionische verbindingen worden bij elkaar gehouden door de elektrostatische aantrekkingskracht tussen positieve en negatief geladen ionen. Deze ionen zijn wat een elektrische geleidbaarheid in oplossing mogelijk maakt.
* Valentie 1 geeft meestal aan dat een element ionische bindingen vormt. Elementen met een valentie van 1 verliezen doorgaans één elektron om een stabiele elektronenconfiguratie te bereiken, die een ion vormen met een +1 of -1 lading.
Voorbeelden:
* Natrium (NA) heeft een valentie van 1 en vormt Na+ ionen. Natriumchloride (NaCl) is een klassieke ionische verbinding die elektriciteit leidt wanneer opgelost in water.
* chloor (CL) heeft ook een valentie van 1 en vormt clionen. Nogmaals, dit leidt tot ionische samenstellingsvorming.
Conclusie:
Het is zeer onwaarschijnlijk dat een reactieve vloeistof die geen elektriciteit leidt, een valentie van 1 in zijn verbinding zou hebben. Deze combinatie is in tegenspraak met het typische gedrag van elementen met valentie 1.
Mogelijke uitzonderingen:
Er kunnen enkele zeer specifieke en zeldzame uitzonderingen zijn met zeer covalente verbindingen met ongebruikelijke eigenschappen. Dit zouden echter niet de algemene regel zijn.
 Lijst met dingen die kikkervisjes eten
Lijst met dingen die kikkervisjes eten  Zoutvijver op Antarctica, tussen de zoutste wateren op aarde, wordt van onderaf gevoed
Zoutvijver op Antarctica, tussen de zoutste wateren op aarde, wordt van onderaf gevoed Wetenschappers op Arctische missie maken ongeplande omweg naar pool
Wetenschappers op Arctische missie maken ongeplande omweg naar pool De pandemie van het coronavirus kan gebouwen ziek maken, te
De pandemie van het coronavirus kan gebouwen ziek maken, te Groener gaan:Finlands nieuwe gasgestookte ijsbreker
Groener gaan:Finlands nieuwe gasgestookte ijsbreker
Hoofdlijnen
- Belangrijkste kenmerk van een microscoop?
- Wat zijn de chemische namen van de vier macromoleculen?
- Waar vind je een wetenschappelijk laboratorium dat de ziekte van Alzheimer bestudeert?
- Wat gebeurt er als een eigenschap codominante allelen toont?
- Ontdekking van orgaanontwikkeling kan strijd tegen kanker stimuleren
- Een smakelijke wat trekt hongerige dieren aan die de plant kunnen helpen zijn zaden te verspreiden?
- Welke cellen verliezen hun vermogen om te repliceren en te verdelen?
- Hebben eiwitten lipiden koolhydraten en nucleïnezuren monomeren?
- Wat heeft chemicaliën die voedseldeeltjes afbreken en celonderdelen in de dierlijke cel versleten?
- Eerste flexibele geheugenapparaat dat ferro-elektrisch materiaal van oxide gebruikt

- Kunstmatige zuurstokken om virussen te blokkeren
- Een katalysator voor de ontwikkeling van koolstofneutrale technologie van de stralingsversneller

- Wetenschappers ontwikkelen een innovatieve methode voor het vullen en afdichten van pleuraholtes

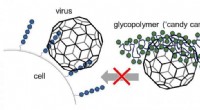
- Geen suikerlaag, maar toch lief
 Nanotechnologie helpt wetenschappers zilver glanzend te houden
Nanotechnologie helpt wetenschappers zilver glanzend te houden Is Zero Degrees North Longitude North?
Is Zero Degrees North Longitude North?  Welk instrument meet de hoogte van een berg?
Welk instrument meet de hoogte van een berg?  Nieuwe techniek om supersponzen te maken is een game changer
Nieuwe techniek om supersponzen te maken is een game changer Wat zijn de veronderstellingen die wetenschappers moeten maken over de natuurlijke wereld?
Wat zijn de veronderstellingen die wetenschappers moeten maken over de natuurlijke wereld?  Wat zijn 3 mechanismen en aanpassingen voor zaadverspreiding?
Wat zijn 3 mechanismen en aanpassingen voor zaadverspreiding?  Voors en tegens van Solar Film voor thuis Windows
Voors en tegens van Solar Film voor thuis Windows  Staten die zwaar investeren in wetgevende macht hebben meer invloed op openbaar beleid
Staten die zwaar investeren in wetgevende macht hebben meer invloed op openbaar beleid
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap © https://nl.scienceaq.com

