
Wetenschap
Wat is het verschil tussen een neutraal atoom een ion en opgewonden atoom?
1. Neutraal atoom
* Definitie: Een neutraal atoom heeft een gelijk aantal protonen (positief geladen deeltjes in de kern) en elektronen (negatief geladen deeltjes rond de kern).
* Voorbeeld: Een koolstofatoom met 6 protonen en 6 elektronen.
* kenmerken:
* Elektrisch neutraal (geen netto lading).
* Gevonden in hun meest stabiele staat.
2. Ion
* Definitie: Een ion is een atoom dat een of meer elektronen heeft gewonnen of verloren, wat resulteert in een netto elektrische lading.
* typen:
* kation: Positief geladen ion (gevormd wanneer een atoom elektronen verliest). Voorbeeld:natriumion (Na+)
* anion: Negatief geladen ion (gevormd wanneer een atoom elektronen krijgt). Voorbeeld:chloride-ion (Cl-)
* kenmerken:
* Elektrisch geladen (positief of negatief).
* Kan worden gevormd door chemische reacties of door energie te absorberen of vrij te geven.
3. Opgewonden atoom
* Definitie: Een opgewonden atoom is een atoom waarin een of meer elektronen zijn gepromoveerd tot een hoger energieniveau.
* hoe het gebeurt: Dit treedt meestal op wanneer een atoom energie absorbeert (bijvoorbeeld van licht, warmte of botsingen).
* kenmerken:
* Onstabiel en van korte duur.
* Het opgewonden elektron zal uiteindelijk terugkeren naar zijn grondtoestand, waardoor de geabsorbeerde energie vaak wordt vrijgeeft als licht (wat de kleuren verklaart die we zien in vuurwerk en fluorescerende lichten).
* Voorbeeld: Een waterstofatoom in zijn grondtoestand heeft zijn elektron in het laagste energieniveau (n =1). Als het energie absorbeert, kan het elektron worden bevorderd tot een hoger energieniveau (n =2, 3, enz.).
Belangrijkste verschillen:
* opladen: Neutrale atomen hebben geen netto lading. Ionen hebben een netto positieve of negatieve lading. Geëxciteerde atomen zijn nog steeds elektrisch neutraal.
* Elektronenconfiguratie: Neutrale atomen hebben een specifieke elektronenconfiguratie in hun grondtoestand. Ionen hebben een andere elektronenconfiguratie vanwege de versterking of het verlies van elektronen. Geëxciteerde atomen hebben een tijdelijke elektronenconfiguratie met een elektron in een hoger energieniveau.
* stabiliteit: Neutrale atomen zijn over het algemeen stabiel. Ionen kunnen stabiel zijn, afhankelijk van hun lading en de omgeving. Geëxciteerde atomen zijn onstabiel en zullen uiteindelijk terugkeren naar hun grondstaat.
Laat het me weten als je nog meer vragen hebt!
 400 jaar oud mysterie over waarom vroege explosieven paarse rook produceren opgelost door academici
400 jaar oud mysterie over waarom vroege explosieven paarse rook produceren opgelost door academici  Metaal vereenvoudigt de synthese van antilichaamgeneesmiddelen
Metaal vereenvoudigt de synthese van antilichaamgeneesmiddelen Waar vind je neutronen in een atoom?
Waar vind je neutronen in een atoom?  Wat is het doel van een thermometrische titratie?
Wat is het doel van een thermometrische titratie?  De beweging van watermoleculen over selectief premable?
De beweging van watermoleculen over selectief premable?
 Om voedselverspilling te verminderen, wetenschappers maken labels die producten volgen terwijl ze bederven
Om voedselverspilling te verminderen, wetenschappers maken labels die producten volgen terwijl ze bederven Hoe de blauwe economie de toekomst van de Canadese oceanen en haar kustgemeenschappen zal vormgeven
Hoe de blauwe economie de toekomst van de Canadese oceanen en haar kustgemeenschappen zal vormgeven Bugbites van strandzand
Bugbites van strandzand  Kan klimaatverandering een geheel nieuwe categorie orkaan voortbrengen?
Kan klimaatverandering een geheel nieuwe categorie orkaan voortbrengen?  Hoe rode muggen te identificeren
Hoe rode muggen te identificeren
Hoofdlijnen
- Angst voor haaien beïnvloedt zeewiergroei op Fijische koraalriffen
- Hersenen Hoe de dood werkt
- Wat is een wetenschappelijk woord voor snel?
- Wat is het afleiden van de wetenschap?
- Wat is het verschil tussen literatuur en biologie?
- Studie onderzoekt welke micro-organismen op Mars nodig zouden hebben om te overleven
- Waarom stijgt je lichaamstemperatuur als je een virus hebt zoals griep?
- Rijd naar gigantisch nieuw zeereservaat op Antarctica
- Temperatuur draagt het meest bij aan de geografische verspreiding van twee gigantische honingbijen
- Onderzoekers ontwikkelen een hardere vezel

- Onderzoekers ontwikkelen nieuwe manier om verontreinigende stoffen uit water te verwijderen

- Aluminiumcomplexen geïdentificeerd via vibrationele vingerafdrukken
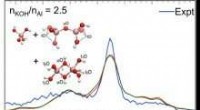
- Panel kondigt Nobelprijs voor scheikunde 2020 aan

- Datawetenschap helpt ingenieurs bij het ontdekken van nieuwe materialen voor zonnecellen en leds
 Waarom zijn sommige sterren die je in de nachtelijke hemel ziet er niet meer zijn?
Waarom zijn sommige sterren die je in de nachtelijke hemel ziet er niet meer zijn?  Waarom mensen zichzelf graag voor de gek houden met sportrituelen en bijgeloof
Waarom mensen zichzelf graag voor de gek houden met sportrituelen en bijgeloof  Het verwijderen van giftig kwik uit verontreinigd water
Het verwijderen van giftig kwik uit verontreinigd water WhatsApp-gebruikers geadviseerd om te updaten ter bescherming
WhatsApp-gebruikers geadviseerd om te updaten ter bescherming Wat is het proces van water of ijskristallen die uit de lucht vallen?
Wat is het proces van water of ijskristallen die uit de lucht vallen?  Waarom zijn de prairies boomloze graslanden?
Waarom zijn de prairies boomloze graslanden?  Hoe lang kan vezelversterkte polymeer betonconstructies ondersteunen? Wetenschappers antwoorden
Hoe lang kan vezelversterkte polymeer betonconstructies ondersteunen? Wetenschappers antwoorden Wat zijn de grootste en helderste sterren?
Wat zijn de grootste en helderste sterren?
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap © https://nl.scienceaq.com

