
Wetenschap
Welke wordt niet aangenomen door de kinetische moleculaire theorie voor gassen?
Veronderstellingen van de kinetische moleculaire theorie:
1. gassen bestaan uit kleine deeltjes (atomen of moleculen) die in constante, willekeurige beweging zijn.
2. Het volume van de gasdeeltjes is te verwaarlozen in vergelijking met het totale volume van de container. (Dit is de reden waarom gassen zeer samendrukbaar zijn.)
3. Er zijn geen aantrekkelijke of afstotende krachten tussen gasdeeltjes. (Dit is waarom gassen de neiging hebben om uit te breiden om hun containers te vullen.)
4. botsingen tussen gasdeeltjes en de containerwanden zijn perfect elastisch. (Er gaat geen energie verloren tijdens deze botsingen.)
5. De gemiddelde kinetische energie van de gasdeeltjes is recht evenredig met de absolute temperatuur van het gas. (Dit verklaart waarom gassen uitzetten wanneer ze worden verwarmd.)
Het antwoord:
De veronderstelling niet Gemaakt door de kinetische moleculaire theorie is:
* De gasdeeltjes bewegen allemaal met dezelfde snelheid.
Waarom?
De kinetische moleculaire theorie stelt dat de * gemiddelde * kinetische energie evenredig is met de temperatuur. Dit betekent dat hoewel sommige deeltjes sneller bewegen, anderen langzamer bewegen. De verdeling van snelheden wordt beschreven door de distributie van Maxwell-Boltzmann.
Laat het me weten als je op een van deze punten meer uitleg wilt!
Hoofdlijnen
- Begrijpen hoe het COVID-19-virus het lichaam binnendringt en medicijnen die de infectie kunnen verzachten
- De ontdekking van oude rotsindrukken suggereert dat het vermogen om verhoornde huid te vormen teruggaat tot de vroege evolutie van tetrapoden
- Wat is een sequencing-connectief?
- Muizen helpen onderzoekers onderzoeken hoe het dieet van koeien het melkvetgehalte beïnvloedt
- Wat is de rol van mRNA bij de eiwitsynthese?
- Welke verklaring beschrijft een wetenschappelijke theorie?
- Studie werpt nieuw licht op hoe dieren en planten reageren op veranderingen in de omgeving
- Koeltechnologie om de levensvatbaarheid van het gekoelde muizensperma gedurende 10 dagen te behouden
- Duwen of trekken? Hoeveel mariene organismen zwemmen er?
- Bepaling van de kristalstructuur van een DNA-gestabiliseerd zilveren nanocluster
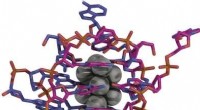
- Hoogwaardige en duurzame lithium-ionbatterij met verbeterde prestaties bij lage temperaturen door een prelithiatiestrategie
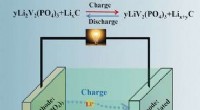
- Koolhydraten omzetten in lipiden voor biobrandstoffen voor microalgen
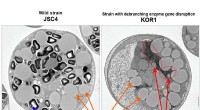
- Meer realistische en nauwkeurige organen-op-chips
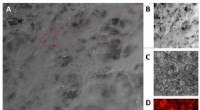
- Van superafdichtingen tot de detectie van gevaarlijke kabels dankzij ionenstralen

 Bioactieve papiercoatings ter vervanging van plastic voor het verpakken van voedsel
Bioactieve papiercoatings ter vervanging van plastic voor het verpakken van voedsel Op welke manieren verschillen zonne- en maanverduisteringen?
Op welke manieren verschillen zonne- en maanverduisteringen?  Waarom absorberen lichte kleuren minder warmte dan donkere kleuren?
Waarom absorberen lichte kleuren minder warmte dan donkere kleuren?  Welk gas hebben planten nodig om te groeien en te overleven?
Welk gas hebben planten nodig om te groeien en te overleven?  2 manieren waarop bacteriën nuttig zijn voor mensen?
2 manieren waarop bacteriën nuttig zijn voor mensen?  Wat als een hond kippenbot eet?
Wat als een hond kippenbot eet?  Noodzaak voor 230V bij 40 ampère, hoe weet u of uw generator groot genoeg is?
Noodzaak voor 230V bij 40 ampère, hoe weet u of uw generator groot genoeg is?  NASA Mars-orbiter volgt regionale stormen achter elkaar
NASA Mars-orbiter volgt regionale stormen achter elkaar
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap © https://nl.scienceaq.com


