
Wetenschap
Als een student scheikunde 825 ml gas verzamelde bij 25 ° C en 7,90 102 torr, hoeveel mol heeft ze verzameld?
1. Converteren eenheden
* volume (v): 825 ml =0,825 L (sinds 1 L =1000 ml)
* temperatuur (t): 25 ° C =298,15 K (omdat k =° C + 273.15)
* druk (p): 7.90 x 10^2 torr =1,04 atm (omdat 1 atm =760 torr)
2. Ideale gaswetvergelijking
De ideale gaswet is:PV =NRT
Waar:
* P =druk (in atm)
* V =volume (in l)
* n =aantal mol
* R =ideale gasconstante (0,0821 l · atm/mol · k)
* T =temperatuur (in k)
3. Oplossen voor n (aantal mol)
Herschik de vergelijking om op te lossen voor n:
n =PV / RT
4. Sluit de waarden aan aan
n =(1,04 atm) * (0,825 l) / (0,0821 l · atm / mol · k) * (298,15 k)
5. Berekenen
n ≈ 0,035 mol
Antwoord: De chemiestudent verzamelde ongeveer 0,035 mol van gas.
 Formaatdehydrogenase reduceert koolstofdioxide tot mierenzuur
Formaatdehydrogenase reduceert koolstofdioxide tot mierenzuur Waarom maakt zout je gasachtig?
Waarom maakt zout je gasachtig?  De 120 jaar oude cold case voor de Grignard-reactie is eindelijk opgelost
De 120 jaar oude cold case voor de Grignard-reactie is eindelijk opgelost Hoeveel natriumatomen zouden er in 100,0 gram natrium zitten?
Hoeveel natriumatomen zouden er in 100,0 gram natrium zitten?  Computermodel voor het ontwerpen van eiwitsequenties die zijn geoptimaliseerd om te binden aan medicijndoelen
Computermodel voor het ontwerpen van eiwitsequenties die zijn geoptimaliseerd om te binden aan medicijndoelen
Hoofdlijnen
- Wat is een thermisch directe cel?
- Welke componenten van het plasmamembraan een dierlijke cel zou je vinden aan het binnenste oppervlak dat direct wordt blootgesteld aan cytoplasma?
- Welke tools gebruiken wetenschappers?
- In genexpressie en eiwitsynthese stroomt informatie van?
- Wat zijn Jan Evangelista Purkinje -bijdragen aan de biologie?
- Zijn er 8 divisies van taxonomie in de wetenschap?
- Wat zijn twee detritivoren van het Taiga Biome?
- Wat voor soort cellen zijn postmitotische cellen?
- Kan in het laboratorium gekweekt plantenweefsel de milieulast van houtkap en landbouw verlichten?
- Hybride enzymkatalysatoren gesynthetiseerd door een de novo benadering voor het uitbreiden van biokatalyse
- Industriële verbinding krijgt milieuvriendelijke reactie
- Een laserfocus op het vinden van betere manieren om hernieuwbare brandstoffen te maken

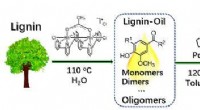
- Nieuwe strategie ontworpen voor duurzame productie van benzylamines uit lignine
- Mica geeft een idee van hoe water mineralen transporteert

 Een scanning transmissie-röntgenmicroscoop voor analyse van chemische toestanden van lithium
Een scanning transmissie-röntgenmicroscoop voor analyse van chemische toestanden van lithium Nanotech-systeem, cellulaire verwarming kan de behandeling van eierstokkanker verbeteren
Nanotech-systeem, cellulaire verwarming kan de behandeling van eierstokkanker verbeteren Terahertz computerchip nu binnen handbereik
Terahertz computerchip nu binnen handbereik Hoeveel mph is 503 knopen?
Hoeveel mph is 503 knopen?  Opening in korst door welke magma stroomt?
Opening in korst door welke magma stroomt?  Het volgen van golven van zonnevlekken geeft nieuw zonne-inzicht
Het volgen van golven van zonnevlekken geeft nieuw zonne-inzicht NASA-ruimtevaartuig zoemt Jupiter-maan Europa, het dichtst in jaren
NASA-ruimtevaartuig zoemt Jupiter-maan Europa, het dichtst in jaren Zwavel in elke porie:verbeterde batterijen met koolstofnanodeeltjes
Zwavel in elke porie:verbeterde batterijen met koolstofnanodeeltjes
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap © https://nl.scienceaq.com

