
Wetenschap
Wanneer chemische binding optreedt?
De station voor stabiliteit:
* octetregel: Atomen hebben de neiging om elektronen te winnen, verliezen of delen om een volledige buitenste schaal van acht elektronen te bereiken (behalve voor waterstof en helium, die er slechts twee nodig hebben). Deze volledige buitenste schaal is zeer stabiel en maakt het atoom minder reactief.
* elektrostatische interacties: De positief geladen kern van een atoom trekt de negatief geladen elektronen van andere atomen aan. Deze aantrekkingskracht is de basis van chemische binding.
Soorten chemische binding:
* ionische binding: Het ene atoom brengt elektronen volledig over naar het andere, waardoor ionen met tegengestelde ladingen worden gecreëerd. Deze ionen worden bij elkaar gehouden door elektrostatische krachten. Voorbeeld:NaCl (natriumchloride)
* Covalente binding: Atomen delen elektronen om een stabiele configuratie te bereiken. Dit delen kan gelijk zijn (niet -polair covalente) of ongelijk (polaire covalente), afhankelijk van het elektronegativiteitsverschil tussen de atomen. Voorbeeld:h₂o (water)
* Metallic binding: Valentie -elektronen worden gedelokaliseerd en beweegt vrij door een rooster van positief geladen metaalionen. Dit creëert een sterke, maar flexibele binding. Voorbeeld:koper (cu)
factoren die binding beïnvloeden:
* elektronegativiteit: Het vermogen van een atoom om elektronen in een binding aan te trekken. Hoe groter het verschil in elektronegativiteit tussen twee atomen, hoe groter de kans dat ze een ionische binding vormen.
* ionisatie -energie: De energie die nodig is om een elektron uit een atoom te verwijderen.
* Elektronenaffiniteit: De verandering in energie wanneer een atoom een elektron krijgt.
Sleutelpunten:
* Chemische binding is cruciaal voor de vorming van alle materie die we om ons heen zien.
* De sterkte en het type chemische bindingen bepalen de fysische en chemische eigenschappen van moleculen en verbindingen.
Laat het me weten als je een van dit soort binding in meer detail wilt verkennen!
 Wetenschappers vinden ijzersneeuw in de kern van de aarde
Wetenschappers vinden ijzersneeuw in de kern van de aarde Top 5 gadgets op zonne-energie
Top 5 gadgets op zonne-energie  Snakebites:We dachten dat we een winnend nieuw tegengif hadden bedacht, maar toen flopte het. Waarom dat een goede zaak bleek te zijn
Snakebites:We dachten dat we een winnend nieuw tegengif hadden bedacht, maar toen flopte het. Waarom dat een goede zaak bleek te zijn  Hoe zich te ontdoen van zeewier
Hoe zich te ontdoen van zeewier  Char-toepassing herstelt de koolstof in de bodem en de productiviteit
Char-toepassing herstelt de koolstof in de bodem en de productiviteit
Hoofdlijnen
- Wat is Ester van Wood Rosen?
- Wat gebruikt chemosynthese om voedsel te maken?
- Wat is een vrijgesteld menselijk exemplaar?
- Hoe Beschrijf het proces van celdeling?
- Waarom is dat stamcel slecht voor ons lichaam?
- Welke zoogdieren overwinteren?
- Wordt de microvilli gevonden in een plant- of dierencel?
- Wat is de Phlogiston?
- Wat zijn de cellen opgeslagen in eierstokken?
- Dalian Coherent Light Source onthult nieuwe dissociatiekanalen in ethaanfotochemie

- Goedkope katalysator helpt zeewater op grote schaal in brandstof te veranderen

- Gestresste cacaobomen kunnen smaakvollere chocolade produceren
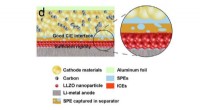
- Onderzoekers ontwerpen dendrietvrije lithiumbatterij
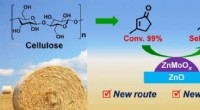
- Onderzoekers synthetiseren biobased methylcyclopentadieen met 3-methylcyclopent-2-enon
 Wat heeft Abraham Lincoln uitgevonden?
Wat heeft Abraham Lincoln uitgevonden?  Wat is het verschil tussen fotosy thisis en cellulaire ademhaling?
Wat is het verschil tussen fotosy thisis en cellulaire ademhaling?  Hoe schrijf je de chemische formules van verbindingen met polyatomaire ionen?
Hoe schrijf je de chemische formules van verbindingen met polyatomaire ionen?  Brand in Californië barst los in de buurt van de dodelijkste bosbrand in de VS
Brand in Californië barst los in de buurt van de dodelijkste bosbrand in de VS Waarom vormde werk de basis van het moderne model zonnestelsel?
Waarom vormde werk de basis van het moderne model zonnestelsel?  Noem drie deeltjesversnellers in de VS en beschrijf het soort experimenten waarvoor elke versneller is ontworpen?
Noem drie deeltjesversnellers in de VS en beschrijf het soort experimenten waarvoor elke versneller is ontworpen?  Zijn rode algen en voorbeeld van een organisme uit de flagellate groep?
Zijn rode algen en voorbeeld van een organisme uit de flagellate groep?  De nieuwste meren van Alaska boeren methaan op
De nieuwste meren van Alaska boeren methaan op
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap © https://nl.scienceaq.com

