
Wetenschap
Welk atoom heeft een grotere aantrekkingskracht voor elctrons-sodium of chloor?
* elektronegativiteit: Elektronegativiteit is een maat voor het vermogen van een atoom om elektronen aan te trekken in een chemische binding. Chloor heeft een hogere elektronegativiteit (3.16) dan natrium (0,93). Dit betekent dat chloor een sterkere trek heeft op gedeelde elektronen.
* Elektronenconfiguratie: Chloor (CL) heeft 7 valentie -elektronen in de buitenste schaal, waardoor het één elektron is kort voor een volledig octet. Dit maakt het zeer reactief en enthousiast om een elektron te krijgen om stabiliteit te bereiken. Natrium (NA) heeft slechts 1 valentie -elektron, waardoor het gemakkelijker is om dat elektron te verliezen en een stabiele configuratie te bereiken.
* ionische binding: Wanneer natrium en chloor reageren, verliest natrium gemakkelijk zijn valentie -elektron en wordt hij een positief geladen ion (Na+). Chloor krijgt dit elektron en wordt een negatief geladen ion (Cl-). Deze sterke aantrekkingskracht tussen tegengesteld geladen ionen vormt de ionische binding in natriumchloride (NaCl).
In wezen maken de hogere elektronegativiteit van chloor en zijn neiging om een elektron te krijgen het veel aantrekkelijker voor elektronen dan natrium.
 Hoe werd zuurstof gevormd?
Hoe werd zuurstof gevormd?  Wat is een gewelddadige uitbreiding van gassen en het vrijgeven van energie als gevolg van een snelle chemische reactie?
Wat is een gewelddadige uitbreiding van gassen en het vrijgeven van energie als gevolg van een snelle chemische reactie?  Welke elementen zijn in batterijzuur?
Welke elementen zijn in batterijzuur?  Hoe kunnen we seksuele toestemming effectief onderwijzen?
Hoe kunnen we seksuele toestemming effectief onderwijzen?  Hoe kunnen chloorfluorkoolwaterstoffen schadelijk zijn voor de ozonlaag?
Hoe kunnen chloorfluorkoolwaterstoffen schadelijk zijn voor de ozonlaag?
 NASA vindt extra-tropische cycloon Fehi geschoren
NASA vindt extra-tropische cycloon Fehi geschoren Onderzoeker klimaatverandering komt om bij ongeval in Groenland
Onderzoeker klimaatverandering komt om bij ongeval in Groenland Kaarten markeren steden in Michigan, groepen die het zwaarst zullen lijden onder de gevolgen van klimaatverandering
Kaarten markeren steden in Michigan, groepen die het zwaarst zullen lijden onder de gevolgen van klimaatverandering Plasticvervuiling is overal. Studie onthult hoe het reist
Plasticvervuiling is overal. Studie onthult hoe het reist Eigenzinnig zomermoessongedrag beïnvloedt regenval in Oost-Azië
Eigenzinnig zomermoessongedrag beïnvloedt regenval in Oost-Azië
Hoofdlijnen
- Welke cellen bevinden zich in een plantencel?
- Vang me als je kunt:hoe mRNA-therapieën in cellen worden afgeleverd
- Een zeldzame vogel? Genetische analyse zegt van niet
- Welke microscoop zou je gebruiken om een levende amoebe te observeren?
- Wat is het ruwe endoplasmatisch reticulum?
- Kan deze invasieve exotische plaag betere materialen opleveren voor de industrie en de geneeskunde?
- Wat is zoetwaterbiota?
- Wat doen mariene biologen precies?
- Welk ding is vergelijkbaar met een nucleair membraan?
- Nieuwe configuratie van DNA ontdekt

- Nieuwe ontwikkelingen in het zoeken naar moleculaire magneten
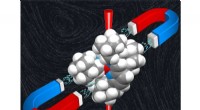
- 2 wetenschappers winnen Nobelprijs voor scheikunde voor tool voor genbewerking

- Nieuwe fotokatalysatoren kunnen door zonne-energie aangedreven omzetting van koolstofdioxide in brandstof uitvoeren

- Onderzoekers ontwikkelen nieuwe combinatorische eiwitbibliotheek
 Wat is drusy kwarts?
Wat is drusy kwarts?  Van kwantumtrillingen tot nanodiamanten, ongebruikelijke gereedschapskist zet gevaarlijke SARS-CoV-2-varianten onder toezicht
Van kwantumtrillingen tot nanodiamanten, ongebruikelijke gereedschapskist zet gevaarlijke SARS-CoV-2-varianten onder toezicht Hoeveel natrium komt er in de natuur voor?
Hoeveel natrium komt er in de natuur voor?  Kleine implantaten voor cellen zijn functioneel in vivo
Kleine implantaten voor cellen zijn functioneel in vivo Hoe een onderzeeër te bouwen voor een Kids Science Project
Hoe een onderzeeër te bouwen voor een Kids Science Project Nobelprijswinnaars zeggen dat er verandering komt voor vrouwen in de wetenschappen
Nobelprijswinnaars zeggen dat er verandering komt voor vrouwen in de wetenschappen Welk eiland is in de buurt van het symbool 30 graden N?
Welk eiland is in de buurt van het symbool 30 graden N?  Hoe ontstaat bolbliksem?
Hoe ontstaat bolbliksem?
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap © https://nl.scienceaq.com

