
Wetenschap
Welk volume van 0,150 M HCLO4-oplossing is nodig om 60 ml 0F 8.6510-2M NaOH te neutraliseren?
1. Schrijf de gebalanceerde chemische vergelijking:
HCLO₄ (aq) + NaOH (aq) → NaClo₄ (aq) + h₂o (l)
2. Bepaal de mol NaOH:
* Moles =Molarity * volume (in liters)
* Mol NaOH =(8,65 x 10⁻² m) * (60 ml / 1000 ml / l) =5,19 x 10⁻³ mol
3. Gebruik stoichiometrie om mol hclo₄ te vinden:
* Uit de evenwichtige vergelijking reageert 1 mol HCLO₄ met 1 mol NaOH.
* Daarom benodigde mol hclo₄ nodig =5,19 x 10⁻³ mol
4. Bereken het volume van HCLO₄ -oplossing:
* Volume =mol / molariteit
* Volume van hclo₄ =(5,19 x 10⁻³ mol) / (0,150 m) =0,0346 l
5. Converteren naar milliliter:
* Volume van hclo₄ =0,0346 l * 1000 ml/l =34,6 ml
Antwoord: Je hebt 34,6 ml nodig van 0,150 M HCLO₄ -oplossing om 60 ml 8,65 x 10⁻² MAOH -oplossing te neutraliseren.
 Het giswerk uit de forensische analyse van vingerafdrukken halen
Het giswerk uit de forensische analyse van vingerafdrukken halen Verdringt zwavel waterstof bij reactie met verdunde minerale zuren?
Verdringt zwavel waterstof bij reactie met verdunde minerale zuren?  Nieuw begrip van condensatie kan leiden tot een betere condensor van de elektriciteitscentrale, de-icing materialen
Nieuw begrip van condensatie kan leiden tot een betere condensor van de elektriciteitscentrale, de-icing materialen Geeft het aantal neutronen in de kern een atoom een unieke chemische aard?
Geeft het aantal neutronen in de kern een atoom een unieke chemische aard?  Numerieke modellering voor het voorspellen van de degradatie van historische olieverfschilderijen
Numerieke modellering voor het voorspellen van de degradatie van historische olieverfschilderijen
 Welke informatie kunnen wetenschappers krijgen van fossielen?
Welke informatie kunnen wetenschappers krijgen van fossielen?  Deeltjes van verf, pesticiden kunnen dodelijke gevolgen hebben
Deeltjes van verf, pesticiden kunnen dodelijke gevolgen hebben Studie van boomringen biedt meer bewijs van poolwaartse migratie van tropische stormen
Studie van boomringen biedt meer bewijs van poolwaartse migratie van tropische stormen Duizenden protesteren tegen door China gesteunde megadam in Myanmar
Duizenden protesteren tegen door China gesteunde megadam in Myanmar Groene mangoschil - een gladde oplossing voor met olie verontreinigde bodems
Groene mangoschil - een gladde oplossing voor met olie verontreinigde bodems
Hoofdlijnen
- Naar welk phylum behoort een bacterie als deze een celwand heeft?
- Tonnen leven diep in het aardoppervlak gevonden
- Zoektocht naar nieuwe medicijnen kan worden geholpen door celontdekking
- Overeenkomsten tussen huidcellen en zenuwen
- Door schadesporen in kaart te brengen, kunnen onderzoekers het water volgen in Photosystem II
- De natuur laat zien hoe bacteriën lignine afbreken en geeft beter inzicht om biobrandstoffen te maken
- Wordt een plantencel beschouwd als veel cellen organisme?
- Wetenschappers ontdekken hoe mensen grotere hersenen ontwikkelen dan andere apen
- Waar bevindt de kern zich in plantencel?
- Efficiënte depolymerisatie in vaste toestand van PET-afval

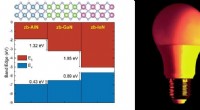
- Helder vroeg licht van LED's
- Synthese van een zeldzaam metaalcomplex van lachgas opent nieuwe perspectieven voor
- Nieuw tandheelkundig materiaal is bestand tegen tandplak en doodt microben, tandheelkundig team vindt

- Een potje poolen in de live cell
 Wanneer u een helling gebruikt, wat gebeurt er met de afstand over welke kracht uitoefenen?
Wanneer u een helling gebruikt, wat gebeurt er met de afstand over welke kracht uitoefenen?  De enorme aardbeving legt problemen bloot in de manier waarop Nieuw-Zeeland zich voorbereidt
De enorme aardbeving legt problemen bloot in de manier waarop Nieuw-Zeeland zich voorbereidt  Modelsimulatie-experimenten geven wetenschappers een beter begrip van factoren die moessongedrag beïnvloeden
Modelsimulatie-experimenten geven wetenschappers een beter begrip van factoren die moessongedrag beïnvloeden Welk gesmolten metaal vormt de kern van de aarde?
Welk gesmolten metaal vormt de kern van de aarde?  Wat zijn de gevaren van zonnestralen door sneeuw?
Wat zijn de gevaren van zonnestralen door sneeuw?  Hoeveel zonnestelsels worden er naar schatting binnen onze Galaxy?
Hoeveel zonnestelsels worden er naar schatting binnen onze Galaxy?  Wat gebruikten de eerste astronauten om lichtsnelheid op te staan in plaats van motoren?
Wat gebruikten de eerste astronauten om lichtsnelheid op te staan in plaats van motoren?  Onderzoekers onderzoeken Turkije om de impact van de klimaattoezeggingen van Parijs in 2015 op een nationale economie te beoordelen
Onderzoekers onderzoeken Turkije om de impact van de klimaattoezeggingen van Parijs in 2015 op een nationale economie te beoordelen
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap © https://nl.scienceaq.com

