
Wetenschap
Hoeveel elektronen zou koolstof moeten krijgen om een covalente binding te krijgen?
* CO2 -elektronische configuratie: Koolstof heeft 6 elektronen. De elektronische configuratie is 1S²2S²2P². Het heeft 4 elektronen in zijn buitenste schaal (2s²2p²).
* De octetregel: Atomen hebben de neiging om elektronen te winnen, verliezen of delen om een stabiele configuratie te bereiken met 8 elektronen in hun buitenste schaal (de octetregel).
* Covalente binding: Koolstof bereikt deze stabiliteit door zijn 4 valentie -elektronen te delen met andere atomen, waardoor vier covalente bindingen worden gevormd.
Voorbeeld: In methaan (CH₄) deelt Carbon zijn vier valentie -elektronen met vier waterstofatomen, waardoor vier enkele covalente bindingen worden gevormd. Elk waterstofatoom draagt één elektron bij aan het gedeelde paar, waardoor het Octet van Carbon wordt voltooid.
 Hoe beschrijf je deeltjes in een oplossing?
Hoe beschrijf je deeltjes in een oplossing?  De moleculaire massa van de verbinding is 132 AMU Welke formule?
De moleculaire massa van de verbinding is 132 AMU Welke formule?  Hoe noem je een stof die de lucht- of watergrond vervuilt?
Hoe noem je een stof die de lucht- of watergrond vervuilt?  Niet-invasieve beeldvorming van atomaire rangschikking op sub-angstromschaal in 2D hybride perovskieten
Niet-invasieve beeldvorming van atomaire rangschikking op sub-angstromschaal in 2D hybride perovskieten Waarom trekken niet -metalen elementen elektronen zo effectief op tijdens een reactie?
Waarom trekken niet -metalen elementen elektronen zo effectief op tijdens een reactie?
 Hoe ziet de geest van niet-menselijke wezens er werkelijk uit?
Hoe ziet de geest van niet-menselijke wezens er werkelijk uit?  Indonesië stopt ontwikkeling nieuwe palmolieplantages
Indonesië stopt ontwikkeling nieuwe palmolieplantages GPM-satelliet vindt zware regenval in krachtige orkaanlaan
GPM-satelliet vindt zware regenval in krachtige orkaanlaan Mijnbouw drijft het moderne leven aan, maar kan land met littekens en vervuilde wateren achterlaten
Mijnbouw drijft het moderne leven aan, maar kan land met littekens en vervuilde wateren achterlaten Mangroven in Florida onthullen complexe relatie tussen klimaat en natuurlijke systemen
Mangroven in Florida onthullen complexe relatie tussen klimaat en natuurlijke systemen
Hoofdlijnen
- Mysterieuze nieuwe DNA-structuur gevonden in levende menselijke cellen
- Wat is een celwand op plantencel?
- In welk proces zijn zowel DNA als RNA betrokken?
- Hoe weeft een spin zijn web?
- Waarom kan Beta -deeltjes niet bestaan in de kern?
- Wat zijn de vier macromoleculen van het leven?
- Wanneer vormden bacteriën?
- Wat is het reproductieve systeem van vrouwelijke geslachtscel en mannelijke cel?
- Wat is de wetenschappelijke naam van Sack Race?
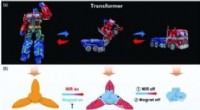
- Magnetisch gestuurd, op hydrogel gebaseerde slimme transformatoren
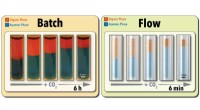
- Groene aanpak versnelt procesoptimalisatie en terugwinning van schakelbare oplosmiddelen
- Nieuwe biosensoren detecteren snel coronaviruseiwitten en antilichamen
- Nieuwe 3D-röntgentechniek onthult geheimen van binnenuit botten

- Ammoniak breken:een nieuwe katalysator om bij lage temperaturen waterstof te maken uit ammoniak

 Pigment voor de kleur sepia werd oorspronkelijk verkregen van welk waterdier?
Pigment voor de kleur sepia werd oorspronkelijk verkregen van welk waterdier?  Ultrakleine nanocavity geavanceerde technologie voor veilige op kwantum gebaseerde gegevensversleuteling
Ultrakleine nanocavity geavanceerde technologie voor veilige op kwantum gebaseerde gegevensversleuteling Rust Belt-gentrificatie en hoe dit de armen schaadt
Rust Belt-gentrificatie en hoe dit de armen schaadt  Waarom worden sommige mensen zwaarder en anderen niet?
Waarom worden sommige mensen zwaarder en anderen niet?  Waarom het goed is voor kinderen om vrienden met verschillende sociaal-economische achtergronden te hebben
Waarom het goed is voor kinderen om vrienden met verschillende sociaal-economische achtergronden te hebben  Waarom wordt kwarts gebruikt bij het schuren van poeder?
Waarom wordt kwarts gebruikt bij het schuren van poeder?  Wat zal hoogstwaarschijnlijk voorkomen wanneer een cel in zoutoplossing wordt geplaatst met een hogere zoutconcentratie dan de cel?
Wat zal hoogstwaarschijnlijk voorkomen wanneer een cel in zoutoplossing wordt geplaatst met een hogere zoutconcentratie dan de cel?  Hoe natuurlijke selectie de afgelopen kwart eeuw op één pinguïnsoort heeft ingewerkt
Hoe natuurlijke selectie de afgelopen kwart eeuw op één pinguïnsoort heeft ingewerkt
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap © https://nl.scienceaq.com

