
Wetenschap
Hoe beïnvloedt een toename van temperatre de chemische reactie?
* Verhoogde moleculaire beweging: Hogere temperaturen zorgen ervoor dat moleculen sneller bewegen en vaker botsen. Deze botsingen zijn wat chemische reacties aandrijven.
* Meer energie voor activering: Chemische reacties vereisen dat een bepaalde minimale hoeveelheid energie, de activeringsenergie wordt genoemd, optreden. Verhoogde temperatuur biedt meer moleculen met voldoende energie om de activeringsbarrière te overwinnen en te reageren.
* Verhoogde botsingseffectiviteit: Hogere temperaturen verhogen niet alleen de frequentie van botsingen, maar maken ze ook meer kans om effectief te zijn, wat betekent dat de moleculen botsen met voldoende energie en de juiste oriëntatie om te reageren.
De relatie tussen temperatuur en reactiesnelheid:
De snelheid van een chemische reactie is vaak exponentieel gerelateerd aan de temperatuur. Dit betekent dat zelfs kleine temperatuurveranderingen aanzienlijk kunnen beïnvloeden hoe snel een reactie verloopt.
De Arrhenius -vergelijking:
De Arrhenius -vergelijking beschrijft deze relatie wiskundig:
k =a * e^(-ea/rt)
Waar:
* k: Constante van de reactie
* a: Pre-exponentiële factor (gerelateerd aan botsingsfrequentie)
* ea: Activeringsenergie
* r: Ideale gasconstante
* t: Temperatuur in Kelvin
Deze vergelijking toont aan dat de snelheidsconstante (en daarom de reactiesnelheid) exponentieel toeneemt naarmate de temperatuur (T) toeneemt.
Uitzonderingen en overwegingen:
* evenwichtsreacties: Hoewel de temperatuur in het algemeen reacties versnelt, kan het het evenwichtspunt van omkeerbare reacties verschuiven. De richting van de verschuiving hangt af van het feit of de reactie exotherme of endotherm is.
* Ontledingsreacties: Sommige reacties, zoals ontledingsreacties, kunnen vertragen bij hogere temperaturen vanwege de instabiliteit van de reactanten.
* Catalyst -effecten: Katalysatoren verlagen de activeringsenergie van een reactie, waardoor deze bij elke bepaalde temperatuur sneller doorgaat.
Samenvattend:
Een toename van de temperatuur versnelt in het algemeen de chemische reacties door de moleculaire beweging te vergroten, waardoor meer energie wordt geboden om de activeringsbarrière te overwinnen en botsingen effectiever te maken. Deze relatie wordt beschreven door de Arrhenius -vergelijking. Er zijn echter uitzonderingen en overwegingen om op de hoogte te zijn, met name met omkeerbare reacties en de rol van katalysatoren.
 Hoe sterk is toxine?
Hoe sterk is toxine?  Wat kost diamantzuiverheid?
Wat kost diamantzuiverheid?  Wat is het proces van waterdruppeltjes of ijskristal die uit de lucht valt?
Wat is het proces van waterdruppeltjes of ijskristal die uit de lucht valt?  Wanneer 100 cm3 van 1,0 molaire natriumhydroxide -oplossing bij 200c werd toegevoegd aan HCl, de temperatuur steeg 26,80c de standaard warmteneutralisati berekenen?
Wanneer 100 cm3 van 1,0 molaire natriumhydroxide -oplossing bij 200c werd toegevoegd aan HCl, de temperatuur steeg 26,80c de standaard warmteneutralisati berekenen?  Wat is de meest voorkomende verbinding in uw lichaam?
Wat is de meest voorkomende verbinding in uw lichaam?
 Attributiewetenschap:klimaatverandering koppelen aan extreem weer
Attributiewetenschap:klimaatverandering koppelen aan extreem weer Terugkijkend op 250 jaar droogte op het Koreaanse schiereiland
Terugkijkend op 250 jaar droogte op het Koreaanse schiereiland Baltimore om afscheid te nemen van plastic zakken bij de kassa, begin volgend jaar
Baltimore om afscheid te nemen van plastic zakken bij de kassa, begin volgend jaar Video:Hoe zullen kuststeden zich aanpassen aan de zeespiegelstijging?
Video:Hoe zullen kuststeden zich aanpassen aan de zeespiegelstijging? GPS-gegevens onthullen mogelijke aardbeving, tsunamigevaar in het noordwesten van Colombia
GPS-gegevens onthullen mogelijke aardbeving, tsunamigevaar in het noordwesten van Colombia
Hoofdlijnen
- Wat is een cel met enkele set chromosomen en daarom is alleen genen?
- Hebben dierencellen een kern die alle acties regelt?
- Splitsing als onderdeel van de embryonale ontwikkeling is onderscheidend omdat het gaat om?
- Welke functie heeft emb-agar?
- Wat is de prominente intracellulaire plantenorganel die voornamelijk water bevat?
- Waarom zijn cellen belangrijk voor levende organismen?
- Welke functie is exclusief voor planten?
- Wat is de betekenis van thermostabele polymerase in DNA -technologie?
- Veranderen mensen wereldwijd de genetische diversiteit van dieren?
- Draagbaar apparaat om opgesloten mensen op te sporen
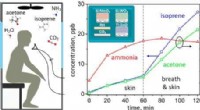
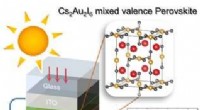
- Loodvrij, efficiënte perovskiet voor fotovoltaïsche cellen
- De oppervlaktechemie van SARS-CoV-2 begrijpen
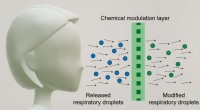
- Gezichtsmasker is bedoeld om het virus te deactiveren om anderen te beschermen
- Onderzoekers ontrafelen meer mysteries van metallische waterstof

 Wat als vloeibare stikstof op de vloer werd gegoten?
Wat als vloeibare stikstof op de vloer werd gegoten?  Hoeveel kWh gebruikt een bol van 45 watt?
Hoeveel kWh gebruikt een bol van 45 watt?  Hoe wordt het verlies van overtollig water en zout uit het lichaam genoemd?
Hoe wordt het verlies van overtollig water en zout uit het lichaam genoemd?  Hoe kan het kookpunt van een chemische stof u vertellen hoe puur het is?
Hoe kan het kookpunt van een chemische stof u vertellen hoe puur het is?  Sinaasappelschillen kunnen geheim zijn voor medicijnen in de lucht, veiliger bruggen
Sinaasappelschillen kunnen geheim zijn voor medicijnen in de lucht, veiliger bruggen Voordelen en nadelen van Digital Meters Vs. Analoge meters
Voordelen en nadelen van Digital Meters Vs. Analoge meters Wat doet koolmonoxide met planten?
Wat doet koolmonoxide met planten?  Wat zijn de 2 sterren onder de maan?
Wat zijn de 2 sterren onder de maan?
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap © https://nl.scienceaq.com

