
Wetenschap
Is CO pure covalent of polair covalent?
* elektronegativiteit: Zuurstof is elektronegatiefer dan koolstof. Dit betekent dat zuurstof een sterkere trek heeft op de gedeelde elektronen in de binding.
* ongelijke delen: De gedeelde elektronen besteden meer tijd dichter bij het zuurstofatoom, waardoor een gedeeltelijke negatieve lading (δ-) op de zuurstof en een gedeeltelijke positieve lading (δ+) op de koolstof ontstaat.
* Dipoolmoment: Deze ongelijke ladingsverdeling resulteert in een dipoolmoment, een maat voor de polariteit van het molecuul.
Hoewel de CO -binding sterk is, leidt het verschil in elektronegativiteit tussen koolstof en zuurstof tot een polaire covalente binding en in het algemeen een polair molecuul.
 Vissen naar nieuwe antibiotica
Vissen naar nieuwe antibiotica Wat is de vergelijking voor de reactie van salicylzuur met acetylchloride en pyridine?
Wat is de vergelijking voor de reactie van salicylzuur met acetylchloride en pyridine?  Welke term beschrijft het verschil tussen het aantal waterstofionen aan tegenovergestelde zijden membraan?
Welke term beschrijft het verschil tussen het aantal waterstofionen aan tegenovergestelde zijden membraan?  Hoe los je een verzadigde oplossing op zonder water toe te voegen?
Hoe los je een verzadigde oplossing op zonder water toe te voegen?  Welke stappen kunnen worden ondernomen om zout in mijnen te zuiveren en te isoleren?
Welke stappen kunnen worden ondernomen om zout in mijnen te zuiveren en te isoleren?
Hoofdlijnen
- Binnenkort zullen er krekels naar Las Vegas neerdalen, maar niet degene die je denkt
- Gevlekte lantaarnvliegen komen weer uit. Maar hoe ver verspreiden ze zich elk jaar?
- Wat is ATP en welk deel van de cel wordt er door gemaakt?
- Van koralen tot gewassen:hoe het leven de plannen voor zijn cellulaire energiecentrales beschermt
- Wat is een allel dat een eigenschap produceert in de heterozygote toestand is?
- Wetenschappers onderzoeken waarom de blinde salamander zo lang leeft
- Wat is de anatomie van een orgel?
- Geef een voorbeeld van veranderingen die tijdens de levenscyclus een meercellulair organisme optreden?
- Welke 2 dingen vormen alle celmembranen?
- Extreme omstandigheden in halfgeleiders

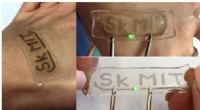
- Team ontwikkelt eenvoudige hydrogel-modificatiemethode voor rekbare en transparante elektronica
- Nobelprijs voor baanbrekende manier om moleculen te bouwen die chemie groener maakten

- Superhydrofobe magnetische spons om water uit olieproducten te helpen zuiveren

- Een nanostructuur van silica met chemo-enzymatische compartimentering

 Nieuw composiet bevordert lignine als een hernieuwbaar 3D-printmateriaal
Nieuw composiet bevordert lignine als een hernieuwbaar 3D-printmateriaal Hoeveel vertrouwen hebben mensen in verschillende soorten wetenschappers?
Hoeveel vertrouwen hebben mensen in verschillende soorten wetenschappers?  Het handhaven van de vrijheid van navigatie:gaat de VS te ver?
Het handhaven van de vrijheid van navigatie:gaat de VS te ver?  Bedrijven verbonden met de maffia:lagere winstgevendheid, meer kans om failliet te gaan
Bedrijven verbonden met de maffia:lagere winstgevendheid, meer kans om failliet te gaan The Food Chain & Fish
The Food Chain & Fish Welke laag van de atmosfeer ligt het dichtst bij de zon?
Welke laag van de atmosfeer ligt het dichtst bij de zon?  Wat is de botanische of wetenschappelijke naam van Sadafuli -plant?
Wat is de botanische of wetenschappelijke naam van Sadafuli -plant?  Waarom is een uniforme lineaire beweging geen versnelde beweging?
Waarom is een uniforme lineaire beweging geen versnelde beweging?
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap © https://nl.scienceaq.com

