
Wetenschap
Waarom is de waterstof die wordt geplaatst bij Alkali Earth Metal Group?
Dit is waarom:
overeenkomsten met alkali -metalen:
* Elektronische configuratie: Waterstof heeft één elektron in zijn buitenste schaal, net als de alkali -metalen.
* De neiging om een elektron te verliezen: Waterstof kan zijn enige elektron verliezen om een positief ion (H+) te vormen, vergelijkbaar met de alkali -metalen.
* reageert met niet -metalen: Waterstof reageert met niet -metalen, zoals halogenen, om verbindingen zoals HCl te vormen, vergelijkbaar met de alkali -metalen die reageren met niet -metalen.
overeenkomsten met halogenen:
* een elektron winnen: Waterstof kan een elektron krijgen om een negatief ionen (H-) te vormen, vergelijkbaar met de halogenen.
* Vorming van diatomaire moleculen: Waterstof bestaat als een diatomisch molecuul (H2), vergelijkbaar met de halogenen (F2, CL2, BR2, I2).
* reageert met metalen: Waterstof kan reageren met sommige metalen om metaalhydriden te vormen (bijv. NAH, CAH2), vergelijkbaar met halogenen die reageren met metalen om zouten te vormen.
Waterstof is echter ook uniek:
* Klein formaat en hoge elektronegativiteit: Waterstof is veel kleiner en heeft een veel hogere elektronegativiteit dan de alkali -metalen.
* vormt geen metalen rooster: In tegenstelling tot alkali -metalen vormt waterstof geen metaalrooster in zijn vaste toestand.
Plaatsing in de periodieke tabel:
Waterstof wordt vaak boven lithium geplaatst in groep 1, maar het wordt soms ook boven fluor in groep 17 geplaatst. Het wordt vaak in een afzonderlijke categorie geplaatst omdat het niet perfect past in beide groep.
Uiteindelijk is de plaatsing van waterstof een kwestie van conventie, en het is nuttig om de unieke eigenschappen en overeenkomsten met zowel de alkalimetalen als halogenen te begrijpen.
 Ontdekking kan leiden tot nieuw katalysatorontwerp om stikstofoxiden in dieseluitlaatgassen te verminderen
Ontdekking kan leiden tot nieuw katalysatorontwerp om stikstofoxiden in dieseluitlaatgassen te verminderen Hoeveel chirale koolstofatomen zijn er aanwezig in 234-trichloorpentaan?
Hoeveel chirale koolstofatomen zijn er aanwezig in 234-trichloorpentaan?  Geeft aan hoe waarschijnlijk dat een element een chemische verandering is?
Geeft aan hoe waarschijnlijk dat een element een chemische verandering is?  Gekarakteriseerde medicijnen vertonen onverwachte effecten
Gekarakteriseerde medicijnen vertonen onverwachte effecten Is koolstofmetaal niet -metaal of metalloïde?
Is koolstofmetaal niet -metaal of metalloïde?
Hoofdlijnen
- Wat is het proces waarbij DNA wordt gedupliceerd?
- De evolutionaire oorsprong van waarom je geprogrammeerd bent om van suiker te houden
- Hoe mitochondriën de snee maken:wanneer en waar de krachtcentrale van de cel zich deelt
- Wat zijn vier resultaten van wetenschappelijk onderzoek?
- Vermeld de drie delen van de celtheorie en beschrijf kort hoe het zich met u verhoudt?
- In welke soort is de eistemperatuur het meest waarschijnlijk dat het geslacht van jongeren beïnvloedt?
- Bergleeuwen uit Zuid-Californië vertonen de eerste reproductieve effecten van inteelt
- Wat vormt weefsel?
- Ongebreidelde bosbranden hebben ooit geleid tot wereldwijde massale uitsterving, zeggen wetenschappers. Kan het nog een keer gebeuren?
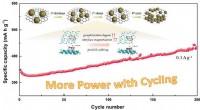
- Verfijning van deeltjes induceert en verhoogt de cycluscapaciteit van natrium/lithium-ionbatterijen
- Onderzoek bevestigt dat verwarming de sterkte van een type hydrogel kan vergroten

- Een nieuwe manier om met zonlicht schone waterstofbrandstof te maken uit water

- Chemici synthetiseren platte siliciumverbindingen

- Verbeterde sterkte en taaiheid in een legering met hoge entropie via geordende zuurstofcomplexen
 Hematietrijke afzettingen in Capri Chasma
Hematietrijke afzettingen in Capri Chasma Wat zijn de functies van zure mantel?
Wat zijn de functies van zure mantel?  Kenmerken van planten die het klimaat in de woestijn kunnen overleven
Kenmerken van planten die het klimaat in de woestijn kunnen overleven Wat wordt geproduceerd door cellen die zijn geïnfecteerd met virussen?
Wat wordt geproduceerd door cellen die zijn geïnfecteerd met virussen?  Wat is een verharde rots?
Wat is een verharde rots?  Is er een object in het universum zonder zwaartekracht?
Is er een object in het universum zonder zwaartekracht?  Hersenfuncties nabootsen met grafeen-diamantverbindingen
Hersenfuncties nabootsen met grafeen-diamantverbindingen De oceaan zit vol met kleine plastic deeltjes - we hebben een manier gevonden om ze te volgen met satellieten
De oceaan zit vol met kleine plastic deeltjes - we hebben een manier gevonden om ze te volgen met satellieten
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap © https://nl.scienceaq.com

