
Wetenschap
Wat gebeurt er als twee edelgassen worden gecombineerd?
Dit is waarom:
* Volledige valentieschalen: Nobele gassen hebben een volledige buitenste schaal van elektronen (8 elektronen, behalve voor helium dat 2 heeft). Dit maakt ze zeer stabiel en niet -reactief.
* Zwakke intermoleculaire krachten: De enige krachten die nobele gasatomen in elkaar houden, zijn zwakke van der Waals -krachten. Deze krachten zijn niet sterk genoeg om chemische bindingen te creëren.
Daarom zullen ze, wanneer twee edelgassen worden gecombineerd, eenvoudig een mengsel vormen, geen verbinding. Een mengsel van helium en neon zou bijvoorbeeld gewoon een gas zijn dat beide gassen bevat.
Er zijn echter enkele uitzonderingen:
* Onder extreme omstandigheden: Bij zeer hoge druk of lage temperaturen kunnen sommige edelgassen verbindingen vormen met andere elementen, zoals Xenon Hexafluoride (XEF 6 ).
* van der Waals interacties: Hoewel ze geen bindingen vormen, kunnen edelgassen met elkaar communiceren via zwakke Van der Waals -krachten. Deze interacties kunnen hun fysieke eigenschappen beïnvloeden, zoals kookpunt.
Samenvattend: Het combineren van edelgassen resulteert meestal in een eenvoudig mengsel zonder chemische binding. Hoewel er enkele uitzonderingen zijn onder extreme omstandigheden, blijven edelgassen over het algemeen inert en niet -reactief.
 Hoe wordt liefde gras verspreid?
Hoe wordt liefde gras verspreid?  Gericht op Trump, House stemt in met wetsvoorstel om VS in klimaatakkoord te houden
Gericht op Trump, House stemt in met wetsvoorstel om VS in klimaatakkoord te houden wetenschappers, Zo gebruik je minder plastic
wetenschappers, Zo gebruik je minder plastic Emissies van verschillende ozonafbrekende chemicaliën zijn groter dan verwacht
Emissies van verschillende ozonafbrekende chemicaliën zijn groter dan verwacht Er blijft geen winbare olie achter in het water door de glans voor de kust van Zuid-Californië, zeggen functionarissen
Er blijft geen winbare olie achter in het water door de glans voor de kust van Zuid-Californië, zeggen functionarissen
Hoofdlijnen
- Nieuwe genen op verslechterend Y-chromosoom
- Studie beslecht 125 jaar durend debat over hoe stikstofbindende bacteriën de celwanden van peulvruchten doorbreken
- Hoe natuurkunde en biologie samenwerken om de mechanismen van het leven te verkennen
- Hoe komt kooldioxide in een plantencel?
- Hoe insecten verschillende suikers uit elkaar houden
- Kunnen mutaties die in somatische cellen voorkomen, worden doorgegeven aan een nakomelingen van een organismen?
- Nieuwe gen-editor gebruikt om ziekte in embryo's op te lossen:studie
- Hoe overleven verschillende organismen in biomen?
- Angiogenese versus vasculogenese
- Wetenschappers zetten aquacultuurafval om in nieuw biomateriaal voor weefselherstel

- Wetenschappers krijgen het meest realistische beeld tot nu toe van een eiwitstructuur met spikes door het coronavirus
- Wetenschappers gebruiken röntgenstralen om de geheimen van schalie te kraken, een hoeksteen van een van de snelst groeiende energiebronnen van het land
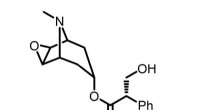
- Onderzoekers melden volledig synthetische route naar scopolamine, middel tegen misselijkheid
- Nieuw licht op het maken van tweedimensionale polymeren

 Dit is de reden waarom muggen je graag bijten, volgens Science
Dit is de reden waarom muggen je graag bijten, volgens Science Onderzoekers ontwikkelen een genoom op bijna chromosoomniveau voor de Mojave-papaverbij
Onderzoekers ontwikkelen een genoom op bijna chromosoomniveau voor de Mojave-papaverbij  Ongewenste getransformeerde cellen verwijderen:mogelijke nieuwe richtingen in kankertherapie
Ongewenste getransformeerde cellen verwijderen:mogelijke nieuwe richtingen in kankertherapie Astronomen observeren het effect van donkere materie op de evolutie van sterrenstelsels
Astronomen observeren het effect van donkere materie op de evolutie van sterrenstelsels  Smokkelaars van neushoornhoorn stappen over op sieraden:rapport
Smokkelaars van neushoornhoorn stappen over op sieraden:rapport Wat is de belangrijkste kleur van de wetenschap?
Wat is de belangrijkste kleur van de wetenschap?  De kanteling van Saturnus veroorzaakt door zijn manen
De kanteling van Saturnus veroorzaakt door zijn manen Doorzichtige circuits:nieuw en goedkoop alternatief voor transparante elektronica
Doorzichtige circuits:nieuw en goedkoop alternatief voor transparante elektronica
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap © https://nl.scienceaq.com

