
Wetenschap
Hoe is een isotoop van een atoom anders dan niet -isotoop?
isotoop versus niet-isotoop
* isotopen: Dit zijn atomen van hetzelfde element die hetzelfde aantal protonen hebben (en dus hetzelfde atoomnummer) maar een ander aantal neutronen. Dit betekent dat ze verschillende atoommassa's hebben.
* Voorbeeld: Carbon-12, koolstof-13 en koolstof-14 zijn allemaal isotopen van koolstof. Ze hebben allemaal 6 protonen, maar ze hebben respectievelijk 6, 7 en 8 neutronen.
* Niet-isotoop: Deze term wordt niet echt gebruikt in de chemie. Een atoom dat geen isotoop is, is gewoon een atoom van een bepaald element. Het is handig om er op deze manier aan te denken:elk atoom van een element is een niet-isotoop tenzij het specifiek wordt geïdentificeerd als een isotoop (zoals koolstof-14).
Sleutelpunten om te onthouden
* Atomisch nummer: Het aantal protonen in de kern van een atoom definieert het element. Alle atomen van hetzelfde element hebben hetzelfde atoomnummer.
* Massienummer: De som van protonen en neutronen in de kern van een atoom. Isotopen verschillen in hun massagummer vanwege het variërende aantal neutronen.
Kortom:
* isotopen zijn variaties van hetzelfde element, alleen verschillend in hun neutronentelling en dus hun massa.
* Niet-isotopen zijn eenvoudig atomen van een specifiek element, zonder enige speciale aanwijzing met betrekking tot het neutronennummer.
Laat het me weten als je nog andere vragen hebt!
 Studie onthult het vervormingsmechanisme bij lage temperatuur van puur titanium
Studie onthult het vervormingsmechanisme bij lage temperatuur van puur titanium  Vooruitgang in de goedkope elektrochemische synthese van ammoniak
Vooruitgang in de goedkope elektrochemische synthese van ammoniak Welk type organische verbinding lost op in verdunde waterige NaOH?
Welk type organische verbinding lost op in verdunde waterige NaOH?  Is het waar dat in een chemische reactiereactanten worden veranderd in producten?
Is het waar dat in een chemische reactiereactanten worden veranderd in producten?  Reactieresultaten voorspellen:machines leren scheikunde
Reactieresultaten voorspellen:machines leren scheikunde
Hoofdlijnen
- Verschillen tussen Protozoa en Protisten
- Hoe beïnvloedt de productie van eikels door eiken tress de ziekte van Lyme bij de mens?
- Een genetische trigger voor de Cambrische explosie ontrafeld?
- Heeft de menselijke intelligentie duizenden jaren geleden een hoogtepunt bereikt?
- Karkas van Noord-Atlantische rechtse walvis gespot in Massachusetts
- Waar is het enige waar gespecialiseerde cellen in worden gevonden?
- Welk phylum zijn orang -oetans?
- Wanneer nakomelingen een mix van de ouders toont, is het ene allel dominant boven het andere?
- Whodunnit, als Aussie-reptielen uitsterven:studie (update)
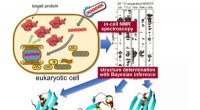
- In-situ meting van 3D-eiwitstructuur in levende eukaryote cellen
- Verbeterde methode om vertakte polymeren te maken

- Ingekapselde eiwitoscillaties veroorzaken dynamische membraanvervormingen in cellen

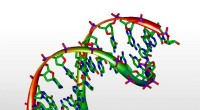
- Ons DNA wordt 's werelds kleinste harde schijf
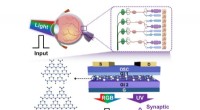
- Op het netvlies geïnspireerde fotonische synapsen op basis van koolstofnitride voor selectieve detectie van UV-licht
 Welke stoffen komen van de buitenkant van de fotosynthese?
Welke stoffen komen van de buitenkant van de fotosynthese?  Een 2e klas wetenschapsproject doen
Een 2e klas wetenschapsproject doen  5 manieren om te weten of er een chemische verandering heeft plaatsgevonden
5 manieren om te weten of er een chemische verandering heeft plaatsgevonden  Waarom kan koolstof macromoleculen vormen?
Waarom kan koolstof macromoleculen vormen?  Een betere planning kan het stedelijk hitte-eilandeffect verminderen
Een betere planning kan het stedelijk hitte-eilandeffect verminderen Wat is het proces waarbij complexe voedselmoleculen worden afgebroken tot eenvoudigere moleculen?
Wat is het proces waarbij complexe voedselmoleculen worden afgebroken tot eenvoudigere moleculen?  Welke plaat -trek beschrijft?
Welke plaat -trek beschrijft?  Een visionaire aanpak:hoe een team toegankelijke kaarten ontwikkelde voor kleurenblinde wetenschappers
Een visionaire aanpak:hoe een team toegankelijke kaarten ontwikkelde voor kleurenblinde wetenschappers
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap © https://nl.scienceaq.com

