
Wetenschap
Wat zijn de intermoleculaire krachten die betrokken zijn bij CH3OH?
* waterstofbinding: Dit is de sterkste intermoleculaire kracht die aanwezig is in methanol. Het waterstofatoom gebonden aan het zeer elektronegatieve zuurstofatoom (O-H) creëert een dipoolmoment, waardoor een sterke waterstofbinding tussen het zuurstofatoom van het ene methanolmolecuul en het waterstofatoom van een ander mogelijk is.
* Dipole-dipole interacties: De polaire O-H-binding in methanol resulteert in een permanent dipoolmoment over het molecuul. Deze dipolen interageren met elkaar en creëren dipool-dipoolkrachten.
* Dispersietroepen in Londen: Dit zijn de zwakste intermoleculaire krachten die aanwezig zijn in alle moleculen, inclusief methanol. Ze komen voort uit tijdelijke schommelingen in elektronenverdeling, waardoor tijdelijke dipolen ontstaan die dipolen in naburige moleculen veroorzaken.
Over het algemeen: Waterstofbinding is de dominante intermoleculaire kracht in methanol, waardoor het een relatief hoog kookpunt is in vergelijking met andere moleculen met een vergelijkbaar molecuulgewicht.
 Arseenrisico in Pakistan veel groter dan verwacht
Arseenrisico in Pakistan veel groter dan verwacht De luchtkwaliteit in Europa vertoont de afgelopen twintig jaar aanzienlijke verbeteringen, zo blijkt uit onderzoek
De luchtkwaliteit in Europa vertoont de afgelopen twintig jaar aanzienlijke verbeteringen, zo blijkt uit onderzoek  Wereld slaagt er niet in om groen Covid-herstelpad te nemen:UN
Wereld slaagt er niet in om groen Covid-herstelpad te nemen:UN Hoe een stedelijk onderzoekscentrum in Los Angeles bugs zal opsporen
Hoe een stedelijk onderzoekscentrum in Los Angeles bugs zal opsporen  Fossiele soorten van Quokka-formaat laten voor de vierde keer zien dat kangoeroes evolueren om bladeren te eten
Fossiele soorten van Quokka-formaat laten voor de vierde keer zien dat kangoeroes evolueren om bladeren te eten
Hoofdlijnen
- Studie beschrijft hoe de driedimensionale architectuur van het genoom verandert tijdens de celcyclus
- Bijenvival:herstelt de bijenpopulatie in Texas zich?
- Groter en levensechter:wat is de toekomst van bioprinted organen?
- Waar worden Bohm -organen gemaakt?
- Wat is predicetatie?
- Factoren die celdeling beïnvloeden
- Enkele cel ziekteverwekker zonder kern?
- Wat worden de interne membranen gevonden in chloroplast?
- De levenscyclus van een rozenplant
- Nieuwe studie onderzoekt de effectiviteit van nucleair afvalfilter op nanoschaal

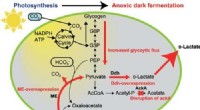
- Methode levert een hoog percentage D-lactaat op met behulp van cyanobacteriën, kan een revolutie teweegbrengen in de productie van bioplastic
- In het laboratorium gemaakt hormoon kan geheime levens van planten onthullen
- In het glas kijken

- Efficiënt drugs de cellen in smokkelen

 De kosten van consumentenleugen:kan het kwaad om een leugentje om bestwil te vertellen?
De kosten van consumentenleugen:kan het kwaad om een leugentje om bestwil te vertellen?  Wat heeft kosmische microgolfachtergrondstraling?
Wat heeft kosmische microgolfachtergrondstraling?  Let op:enorme orkaan van donkere materie passeert de aarde
Let op:enorme orkaan van donkere materie passeert de aarde  Studie benadrukt de menselijke maat van een warmer klimaat
Studie benadrukt de menselijke maat van een warmer klimaat Welk type wind zijn deelscirculatie van deels grote patronen die uit dezelfde richting komen?
Welk type wind zijn deelscirculatie van deels grote patronen die uit dezelfde richting komen?  Magnetische nanoketen laat chemospervuur in tumoren ontploffen
Magnetische nanoketen laat chemospervuur in tumoren ontploffen Is er vandaag de dag leven op Mars en waar?
Is er vandaag de dag leven op Mars en waar?  Eerste experimenteel bewijs voor superionisch ijs
Eerste experimenteel bewijs voor superionisch ijs
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap © https://nl.scienceaq.com

