
Wetenschap
Hoeveel atomen van O2 bevinden zich in een 1,76 -steekproef CO2?
1. Bepaal de molaire massa van CO2
* Koolstof (C) heeft een molaire massa van 12,01 g/mol
* Zuurstof (O) heeft een molaire massa van 16,00 g/mol
* Molaire massa van CO2 =12.01 g/mol + (2 * 16,00 g/mol) =44.01 g/mol
2. Bereken de mol CO2
* We krijgen een voorbeeld van 1,76 g CO2.
* Mol CO2 =(massa CO2) / (molaire massa CO2)
* Mol CO2 =1,76 g / 44.01 g / mol =0,04 mol
3. Bepaal de mol O2
* De chemische formule CO2 vertelt ons dat er 2 mol zuurstofatomen zijn voor elke 1 mol CO2.
* Mol O -atomen =0,04 mol CO2 * (2 mol O atomen / 1 mol CO2) =0,08 mol O atomen
4. Bereken het aantal O2 -moleculen
* Het nummer van Avogadro vertelt ons dat er 6.022 x 10^23 moleculen zijn in één mol van elke stof.
* Aantal O2 -moleculen =(mol O -atomen) * (Avogadro's nummer)
* Aantal O2 -moleculen =0,08 mol * (6.022 x 10^23 moleculen/mol) =4,82 x 10^22 moleculen
Daarom zijn er ongeveer 4,82 x 10^22 o2 moleculen in een 1,76 g monster van CO2.
 Noem het proces waarbij een gas vermengd raakt met een ander gas?
Noem het proces waarbij een gas vermengd raakt met een ander gas?  Hoe heet het huidige atoommodel en waarom noemde het dat?
Hoe heet het huidige atoommodel en waarom noemde het dat?  Milieuvriendelijke katalysator voor het omzetten van methaan in bruikbare gassen met behulp van licht in plaats van warmte
Milieuvriendelijke katalysator voor het omzetten van methaan in bruikbare gassen met behulp van licht in plaats van warmte Goud delven met een computer
Goud delven met een computer Water helpt bij de onverwachte en ultrasnelle synthese van collageenachtig synthetisch poly-L-proline
Water helpt bij de onverwachte en ultrasnelle synthese van collageenachtig synthetisch poly-L-proline
 Wat is het verband tussen winterstormen en de opwarming van de aarde?
Wat is het verband tussen winterstormen en de opwarming van de aarde?  Wanneer een groep op natuurwandeling gaat en alle eetbare planten identificeert. Welk type gegevens is dit?
Wanneer een groep op natuurwandeling gaat en alle eetbare planten identificeert. Welk type gegevens is dit?  Hoe biotische en abiotische factoren de denitrificatiesnelheid van sediment onder wetlandtypen reguleren
Hoe biotische en abiotische factoren de denitrificatiesnelheid van sediment onder wetlandtypen reguleren  Brand in de zone van Tsjernobyl, Kiev zegt dat stralingsniveaus veilig zijn
Brand in de zone van Tsjernobyl, Kiev zegt dat stralingsniveaus veilig zijn Uit fossiele vondsten blijkt dat kelp ver ouder is dan de dieren die we vandaag de dag in de bossen zien
Uit fossiele vondsten blijkt dat kelp ver ouder is dan de dieren die we vandaag de dag in de bossen zien
Hoofdlijnen
- Wat zijn ecosystemen met veel verbonden voedselketens?
- Vergelijking voor glucosemetabolisme
- Ontdekking van eiwit dat de celwandmechanica van planten regelt
- Is cavia -DNA en menselijk identiek?
- Hoe spieren zich ontwikkelen:een dans van cellulaire skeletten
- Wat zijn enkele wetenschappelijke apparaten?
- Hoe kunnen uitstervingen de evolutie beïnvloeden van organismen die een gebeurtenis overleven?
- Onderzoek verklaart waarom hennep en marihuana verschillend zijn
- Nieuwe studie laat zien hoe mierenkolonies zich anders gedragen in verschillende omgevingen
- Wetenschappers ontwikkelen metallo-enzym biosensor voor het monitoren van ethyleenniveaus in fruit
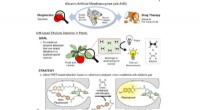
- Onderzoekers rapporteren bio-geïnspireerde selectieve antibiotica
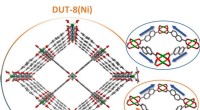
- Nieuwe inzichten in schakelbare MOF-structuren
- Het oplossen van een fossiel mysterie kan de zoektocht naar het leven op Mars helpen
- Onderzoekers vinden een manier om farmacoterrorisme te bestrijden
 Wat zijn magneetbewaarders?
Wat zijn magneetbewaarders?  Onderzoek naar oxidatieve routes in nucleaire brandstof
Onderzoek naar oxidatieve routes in nucleaire brandstof Wat is een concrete pad?
Wat is een concrete pad?  Sociaal leren:Simulatiemodel laat zien hoe groepen belangrijke informatie binnen en tussen generaties kunnen bewaren
Sociaal leren:Simulatiemodel laat zien hoe groepen belangrijke informatie binnen en tussen generaties kunnen bewaren  Klimaatsignalen gedetecteerd in wereldwijd weer
Klimaatsignalen gedetecteerd in wereldwijd weer Saoedi-Arabië zal proberen zijn verslaving aan olie te verminderen
Saoedi-Arabië zal proberen zijn verslaving aan olie te verminderen  Noem de modus van voeding in ronde worm en Plasmodium?
Noem de modus van voeding in ronde worm en Plasmodium?  Onderzoekers ontdekken manier om nanobuisjes aan metalen te binden
Onderzoekers ontdekken manier om nanobuisjes aan metalen te binden
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap © https://nl.scienceaq.com

