
Wetenschap
Waarom koper in groep 1 van de periodieke tabel?
Dit is waarom:
* Elektronenconfiguratie: Koper heeft een elektronenconfiguratie van [AR] 3D¹⁰ 4S¹. Groep 1-elementen (alkali-metalen) hebben slechts één valentie-elektron in hun buitenste S-orbitaal. De configuratie van Copper laat zien dat het één valentie -elektron heeft in de 4s orbital, maar ook een volledige D orbital, die niet typerend is voor groep 1 -elementen.
* chemische eigenschappen: De chemische eigenschappen van Copper verschillen enorm van alkali -metalen. Kopervormen gekleurde verbindingen, heeft een relatief hoog smeltpunt en is minder reactief dan alkalimetalen.
* Periodieke trends: De positie van Coper in de periodieke tabel sluit aan bij zijn eigenschappen, zijnde een overgangsmetaal met een gedeeltelijk gevulde D-orbital.
Laat het me weten als je nog andere vragen hebt over het periodieke tabel!
 Waar wordt hcl geproduceerd?
Waar wordt hcl geproduceerd?  Hoe wordt gas omgezet in warmte?
Hoe wordt gas omgezet in warmte?  Heeft het wonen in de buurt van een olie- of aardgasbron invloed op uw drinkwater?
Heeft het wonen in de buurt van een olie- of aardgasbron invloed op uw drinkwater?  Is aminozuur de basiseenheid van het leven met betrekking tot chemie?
Is aminozuur de basiseenheid van het leven met betrekking tot chemie?  Onderzoekers onderzoeken manieren om antibiotica te verwijderen die meren en rivieren vervuilen
Onderzoekers onderzoeken manieren om antibiotica te verwijderen die meren en rivieren vervuilen
 Risico's voor de menselijke gezondheid berekenen met algemene weergegevens
Risico's voor de menselijke gezondheid berekenen met algemene weergegevens Plaatsgebonden beheer kan koraalriffen beschermen in een veranderend klimaat
Plaatsgebonden beheer kan koraalriffen beschermen in een veranderend klimaat Onderzoekers gebruiken teledetectie om de stikstofdepositie in Noord-China te schatten
Onderzoekers gebruiken teledetectie om de stikstofdepositie in Noord-China te schatten Dieren van de Coastal Desert Biome
Dieren van de Coastal Desert Biome  Met of zonder Trump, Amerikaanse bedrijven bewegen over klimaat
Met of zonder Trump, Amerikaanse bedrijven bewegen over klimaat
Hoofdlijnen
- Nieuwe aanwijzingen waarom er zo weinig antimaterie in het universum is
- Wat is het doel van een anjerkebloem?
- Komt evolutie in een constant of onregelmatig tempo voor?
- Hoe de Amoeben zich reproduceren?
- Wat is een voorbeeld van porfyritische textuur?
- Wat zijn de 6 biomen van de wereld?
- Een nieuw hulpmiddel voor de identificatie van niet-coderend RNA van planten
- Nieuw inzicht in unieke plantchemicaliën kan toekomstige medicijnontwikkeling informeren
- Hoe schimmels hebben bijgedragen aan het ontstaan van het leven zoals wij dat kennen
- Chemici veranderen de richting van de Diels-Alder-reactie volledig

- Mac en kaas naar Mars brengen

- Nieuw, milieuvriendelijke methode om zeldzame aardelementen te extraheren en te scheiden
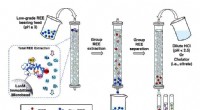
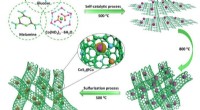
- S, N co-gedoteerde koolstof nanobuis ingekapselde CoS2@Co
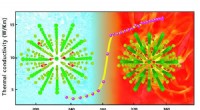
- Wetenschappers vinden nieuw solid-state materiaal voor thermische regeling
 Hoe beïnvloeden vulkanen het klimaat?
Hoe beïnvloeden vulkanen het klimaat?  Wetenschappers observeren nanodraden terwijl ze groeien
Wetenschappers observeren nanodraden terwijl ze groeien Welke temperatuureenheden gebruikt Amerika?
Welke temperatuureenheden gebruikt Amerika?  Wil je een sterrenstelsel ver, ver weg verplaatsen? Een innovatief systeem evalueert de bewoonbaarheid van verre planeten
Wil je een sterrenstelsel ver, ver weg verplaatsen? Een innovatief systeem evalueert de bewoonbaarheid van verre planeten  Geeft een huisartsen straling af?
Geeft een huisartsen straling af?  Duitsland stelt ambitieuzere klimaatdoelen na historische uitspraak
Duitsland stelt ambitieuzere klimaatdoelen na historische uitspraak Toenemende resolutie van gegevens over de temperatuur van het zeeoppervlak veroorzaakt kunstmatige decadale variabiliteit van stormtrack
Toenemende resolutie van gegevens over de temperatuur van het zeeoppervlak veroorzaakt kunstmatige decadale variabiliteit van stormtrack Zweden vervolgt Italiaanse stamcelwetenschapper niet
Zweden vervolgt Italiaanse stamcelwetenschapper niet
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap © https://nl.scienceaq.com

