
Wetenschap
Waarom wordt een waterige oplossing van natriumchloride niet gebruikt om te scheiden van chloride?
* opgeloste ionen: Wanneer NaCl oplost in water, dissocieert het in zijn samenstellende ionen:Na+ en Cl-. Dit betekent dat de chloride -ionen nog steeds aanwezig zijn in de oplossing, niet gescheiden.
* Geen selectieve neerslag: Er is geen gemakkelijke manier om chloride -ionen selectief neer te slaan van een waterige oplossing van NaCl. Je kunt misschien het natrium neerslaan, maar je zou een oplossing van chloride -ionen achterlaten.
* elektrolyse: U zou elektrolyse kunnen gebruiken om natriumchloride te scheiden, maar dit is een complexer en energie-intensief proces.
In plaats van een waterige NaCl -oplossing te gebruiken, zijn hier enkele methoden om chloride -ionen te scheiden:
* Neerslagreacties: Gebruik een reagens dat een onoplosbaar chloridezout vormt. Het toevoegen van zilvernitraat (Agno3) aan een oplossing die chloride -ionen bevat, zal bijvoorbeeld een wit neerslag van zilverchloride (AGCL) produceren.
* ionenuitwisselingchromatografie: Deze techniek maakt gebruik van een hars die selectief chloride -ionen bindt, waardoor ze van andere ionen kunnen worden gescheiden.
* Selectief membraan: Bepaalde membranen kunnen chloride -ionen selectief laten doorgaan tijdens het blokkeren van andere ionen.
Samenvattend: Hoewel NaCl oplost in water, biedt het geen praktische manier om chloride -ionen te isoleren. U moet andere chemische of fysische methoden gebruiken om ze te scheiden.
 Onderzoek toont aan dat het verlies van tropisch bos wordt vergroot door grootschalige landaankopen
Onderzoek toont aan dat het verlies van tropisch bos wordt vergroot door grootschalige landaankopen Wat zijn de bloemen die op water groeien?
Wat zijn de bloemen die op water groeien?  Scholen in Bangkok gesloten vanwege zorgen over luchtvervuiling
Scholen in Bangkok gesloten vanwege zorgen over luchtvervuiling Koolstofemissies van dammen tot nu toe aanzienlijk onderschat
Koolstofemissies van dammen tot nu toe aanzienlijk onderschat Brekende golven en vochttransport zorgen voor extreme neerslag
Brekende golven en vochttransport zorgen voor extreme neerslag
Hoofdlijnen
- Drie tips om een eetbare paddenstoel van een giftige te onderscheiden
- Waarom is het membraan semi -perable?
- Kunnen algen die 'arme leveranciers' zijn, koralen helpen terugkomen na het bleken?
- Wat zijn de twee soorten fermentatie en wat levert elk op?
- Hoeveel chromosomen zitten er bij mitose in elke dochtercel?
- Wat is een prehistorische toolkit en hoe zou deze de menselijke geschiedenis kunnen herschrijven?
- Welke twee groepen zijn nauw verwant evolutionair planten en dieren schimmels?
- Wat is slijmvliesverdikking in de ethmoid luchtcellen?
- Onderzoekers creëren een kunstmatige celcortex, een systeem om te bestuderen hoe cellen zich delen
- Direct oxidatief overdrachtsproces draagt bij aan waterzuivering
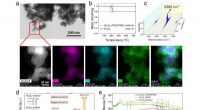
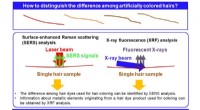
- Binnen een haarbreedte - forensische identificatie van enkel geverfde haarstreng nu mogelijk
- Een kleine cirkelvormige racebaan voor licht kan snel afzonderlijke moleculen detecteren

- Unieke constructies maken van metalen membranen

- De olie uit vervuild water halen

 Wat kwam de eerste natuurkunde of wiskunde?
Wat kwam de eerste natuurkunde of wiskunde?  Coumarineverbindingen uit eikenhouten vaten kunnen bijdragen aan de bittere smaak van wijn en sterke drank
Coumarineverbindingen uit eikenhouten vaten kunnen bijdragen aan de bittere smaak van wijn en sterke drank De ruimte is niet het Wilde Westen:er zijn duidelijke regels voor vrede en oorlog
De ruimte is niet het Wilde Westen:er zijn duidelijke regels voor vrede en oorlog Bedreigde soorten in het Europese loofbos
Bedreigde soorten in het Europese loofbos  Welke 3 energieoverdrachten komen een brandende kaars?
Welke 3 energieoverdrachten komen een brandende kaars?  Hoe windenergie werkt
Hoe windenergie werkt  Waarom de Chinese wetenschap zo geheimzinnig lijkt - en hoe deze op het punt staat te veranderen
Waarom de Chinese wetenschap zo geheimzinnig lijkt - en hoe deze op het punt staat te veranderen Sneeuw op Hawaï:wat heeft de toekomst in petto?
Sneeuw op Hawaï:wat heeft de toekomst in petto?
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap © https://nl.scienceaq.com

