
Wetenschap
Leg uit waarom de overgangsmetalen soms D-Blok-elementen worden genoemd?
Hier is een uitsplitsing:
* Elektronenconfiguratie: Elementen worden georganiseerd op het periodiek systeem op basis van hun elektronenconfiguratie, die beschrijft hoe elektronen worden verdeeld in verschillende energieniveaus en subablellen binnen een atoom.
* orbitalen: Deze energieniveaus zijn verder onderverdeeld in subels, elk overeenkomend met een specifiek type orbitaal. Deze orbitalen worden aangeduid met letters:S, P, D en F.
* D orbitalen: De D -orbitalen zijn een set van vijf orbitalen met complexe vormen. Ze beginnen te vullen na de S -orbitalen in hetzelfde energieniveau.
* overgangsmetalen: Overgangsmetalen bevinden zich in groepen 3-12 van de periodiek systeem. Hun karakteristieke kenmerk is dat hun hoogste energie -elektronen zich in de orbitalen bevinden. IJzer (Fe) heeft bijvoorbeeld de elektronenconfiguratie [AR] 3D
6
4S
2
. De 3D -elektronen zijn de differentiërende elektronen, wat betekent dat ze zijn positie op het periodiek systeem definiëren.
Daarom worden de overgangsmetalen D-block-elementen genoemd omdat hun onderscheidende elektronen de D-orbitalen bezetten.
Hoofdlijnen
- Welke rol speelt afval in aquatische ecosystemen?
- Hoe belangrijk is de oceaan voor het fotosyntheseproces?
- Welke delen van de cel kun je onder een microscoop* zien?
- Wanneer en waarom moeten we sterven?
- Welke onderwerpen maken deel uit van de sociale wetenschappen?
- Wat is het verschil tussen halodurische en halofiele organismen?
- Wat is een blaas?
- Welk ding moet gebeuren voor fotosynthese?
- Wat is de kleinste rattensoort?
- Wetenschappers observeren rechtstreeks de overdracht van licht naar energie in nieuwe zonnecelmaterialen

- Een chemisch functionele fosforversie van natuurlijk rubber
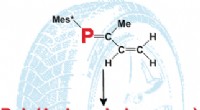
- Baanbrekende techniek maakt de weg vrij voor snelle en goedkope fabricage van snelle medische diagnostische hulpmiddelen

- Computers leren om miljarden mogelijke materialen intelligent te ontwerpen

- Ontcelde spinazie dient als eetbaar platform voor in het laboratorium gekweekt vlees
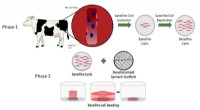
 Wetenschappers gebruiken micro-organismen om functionele bacteriële cellulose in situ te fabriceren
Wetenschappers gebruiken micro-organismen om functionele bacteriële cellulose in situ te fabriceren Klimaatactivisten winnen oproep om nieuwe landingsbaan op Heathrow te voorkomen
Klimaatactivisten winnen oproep om nieuwe landingsbaan op Heathrow te voorkomen Nieuw apparaat maakt de weg vrij voor 3D-geprinte orgels, voedsel
Nieuw apparaat maakt de weg vrij voor 3D-geprinte orgels, voedsel Hoeveel paren niet-bindende elektronen zitten er in een ammoniakmolecuul?
Hoeveel paren niet-bindende elektronen zitten er in een ammoniakmolecuul?  10 wetenschappelijke vragen die u echt moet weten te beantwoorden
10 wetenschappelijke vragen die u echt moet weten te beantwoorden  Meer dan alleen geld bereiden familie- en gemeenschapsbanden tieners voor op succes op de universiteit:studeren
Meer dan alleen geld bereiden familie- en gemeenschapsbanden tieners voor op succes op de universiteit:studeren  Hoe de initiële reactiesnelheid te berekenen
Hoe de initiële reactiesnelheid te berekenen  Wat is koolstofreductie?
Wat is koolstofreductie?
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap © https://nl.scienceaq.com


