
Wetenschap
Wat is de aard van niet-metaaloxide?
1. Covalente binding :Niet-metaaloxiden worden gevormd door de covalente binding tussen niet-metaalatomen. Het elektronegativiteitsverschil tussen niet-metalen is meestal aanzienlijk, wat resulteert in de vorming van polaire covalente bindingen. In koolstofdioxide (CO2) delen de zuurstofatomen bijvoorbeeld elektronen met het koolstofatoom om twee dubbele bindingen te vormen, wat resulteert in een stabiel molecuul.
2. Moleculaire structuur :Niet-metaaloxiden hebben doorgaans moleculaire structuren, wat betekent dat de atomen in afzonderlijke moleculen zijn gerangschikt in plaats van in een uitgebreid rooster. Deze moleculen kunnen diatomisch zijn (bestaande uit twee atomen), polyatomisch (bestaande uit meer dan twee atomen) of zelfs complexe moleculaire structuren. Kooldioxide (CO2) is bijvoorbeeld een diatomisch molecuul, terwijl zwaveltrioxide (SO3) een polyatomisch molecuul is met een trigonale piramidestructuur.
3. Zuurachtige of neutrale aard :Niet-metaaloxiden kunnen verschillend chemisch gedrag vertonen, afhankelijk van hun eigenschappen. Veel niet-metaaloxiden reageren met water en vormen zuren. Deze staan bekend als zure oxiden. Kooldioxide (CO2) reageert bijvoorbeeld met water en vormt koolzuur (H2CO3), terwijl zwaveldioxide (SO2) zwaveligzuur (H2SO3) vormt. Sommige niet-metaaloxiden zijn echter neutraal en reageren niet met water. Koolmonoxide (CO) ondergaat bijvoorbeeld geen enkele reactie met water.
4. Oplosbaarheid :Niet-metaaloxiden vertonen een gevarieerde oplosbaarheid in water. Sommige niet-metaaloxiden, zoals kooldioxide en zwaveldioxide, zijn oplosbaar in water. Wanneer ze in water worden opgelost, kunnen ze zure oplossingen vormen. Andere niet-metaaloxiden, zoals siliciumdioxide (SiO2), zijn daarentegen onoplosbaar in water.
5. Reactiviteit :Niet-metaaloxiden kunnen een reeks reactiviteiten vertonen. Sommige niet-metaaloxiden zijn behoorlijk reactief en kunnen gemakkelijk chemische reacties ondergaan, terwijl andere relatief inert zijn. Koolmonoxide (CO) is bijvoorbeeld een reactief gas dat gemakkelijk met zuurstof wordt gecombineerd om kooldioxide te vormen, terwijl siliciumdioxide (SiO2) een zeer niet-reactieve vaste stof is.
Over het algemeen vertonen niet-metaaloxiden diverse eigenschappen vanwege hun variërende chemische samenstellingen en bindingseigenschappen. Hun covalente aard, moleculaire structuren, zuur of neutraal gedrag, oplosbaarheid in water en reactiviteit dragen bij aan hun unieke rol in chemische reacties en verschillende toepassingen op verschillende gebieden van wetenschap en industrie.
 Calabrese zegt dat een fout heeft geleid tot het aannemen van het LNT-model in de toxicologie
Calabrese zegt dat een fout heeft geleid tot het aannemen van het LNT-model in de toxicologie Hoe het insect zijn vleugels kreeg:wetenschappers vertellen (eindelijk!)
Hoe het insect zijn vleugels kreeg:wetenschappers vertellen (eindelijk!)  Black Star Chicken Informatie
Black Star Chicken Informatie  Onderzoekers vergelijken globale temperatuurvariabiliteit in glaciale en interglaciale perioden
Onderzoekers vergelijken globale temperatuurvariabiliteit in glaciale en interglaciale perioden Een landmodel met laterale grondwaterstroming, waterverbruik, en bodem vries-dooi front dynamiek
Een landmodel met laterale grondwaterstroming, waterverbruik, en bodem vries-dooi front dynamiek
Hoofdlijnen
- Zeewier als biobrandstof? Metabolic engineering maakt het een haalbare optie
- Het Y-chromosoom verdwijnt – dus wat zal er met mannen gebeuren?
- De zes belangrijkste dinosaurusmythen en hoe we ze hebben ontkracht
- Wat is de vrouwelijke gameet?
- Deoxygenatie van de oceaan:een stille aanjager van de ondergang van koraalriffen?
- Hoe planten wonden genezen:mechanische krachten bepalen de richting van celdeling
- De rol van enzymen bij cellulaire ademhaling
- De nadelen van gelelektroforese
- Hoe komt stikstof uit levende organismen terug in de lucht?
- Wetenschappers vinden mogelijke ontbrekende schakel in chemie die leidde tot leven op aarde

- Een mangaanpolymeer gebruiken om xyleenisomeren te scheiden
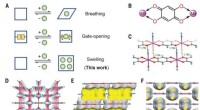
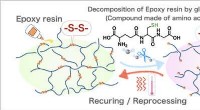
- Nieuwe strategie ter bevordering van hergebruik van met koolstofvezel versterkte kunststoffen
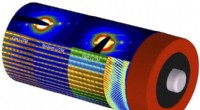
- Batterijmaterialen in kaart brengen met atomaire precisie
- Onderzoekers ontwerpen afstembare, zelfherstellende kleurstoffen voor gebruik in slimme apparaten van de volgende generatie

 Wat betekent PS bij het meten van de ruimte?
Wat betekent PS bij het meten van de ruimte?  Hoe groene algen hun enzymen samenstellen
Hoe groene algen hun enzymen samenstellen High-fidelity simulaties wijzen de weg naar het optimaliseren van warmteoverdracht in huidige en volgende generatie reactoren
High-fidelity simulaties wijzen de weg naar het optimaliseren van warmteoverdracht in huidige en volgende generatie reactoren Is een koolstofvrije,
Is een koolstofvrije,  Staten gaan hun eigen weg bij milieuhandhaving tijdens crisis
Staten gaan hun eigen weg bij milieuhandhaving tijdens crisis Datagestuurde besluitvormingsproces kan eenvoudiger zijn in de bouwsector
Datagestuurde besluitvormingsproces kan eenvoudiger zijn in de bouwsector Ruimtetoerisme - 20 jaar in de maak - is eindelijk klaar voor lancering
Ruimtetoerisme - 20 jaar in de maak - is eindelijk klaar voor lancering De vervagende geest van een lang geleden overleden ster
De vervagende geest van een lang geleden overleden ster
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap © https://nl.scienceaq.com

