
Wetenschap
Hoeveel mol CO2 ontstaat er als 58 g butaan C4H10 in zuurstof verbrandt?
De uitgebalanceerde chemische vergelijking voor de verbranding van butaan is:
$$2C_4H_{10} + 13O_2 -> 8CO_2 + 10H_2O$$
Bereken eerst het aantal mol butaan in 58 g:
$$Mollen \ C_4H_{10} =\frac{58 g}{58,12 g/mol} =1,00 mol$$
Volgens de uitgebalanceerde chemische vergelijking produceert 2 mol butaan 8 mol koolstofdioxide. Daarom produceert 1 mol butaan:
$$Molen \ CO_2 =1,00 mol \ C_4H_{10} \times \frac{8 mol \ CO_2}{2 mol \ C_4H_{10}}$$
$$Mollen \ CO_2 =4,00 mol$$
Dus als 58 g butaan in zuurstof verbrandt, wordt er 4,00 mol koolstofdioxide gevormd.
Hoofdlijnen
- Linnaean-classificatie: definitie, niveaus en voorbeelden (met grafiek)
- Hoe origami ziektediagnoses kan bepalen
- Mutaties die willekeurig optreden worden genoemd?
- Diepe wortels in planten aangedreven door bodemhydrologie
- Hoe vleermuizen het menselijk brein helpen verklaren
- Exosomale afgifte van bèta-catenine kan verklaren waarom CD82 en CD9 tumormetastasen onderdrukken
- Wat wetenschapscommunicatoren zouden kunnen leren van marketingprofessionals
- Hoe vriendelijke schimmels ervoor zorgen dat rijst gedijt
- Houdt mijn hond echt van mij?
- Synthese op het oppervlak van grafeenmoleculen en hun superroosters
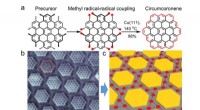
- Nieuw proces bevordert het gebruik van koolstof

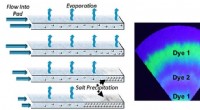
- Op papier gebaseerd apparaat biedt een laag stroomverbruik, langetermijnmethode voor het analyseren van zweet
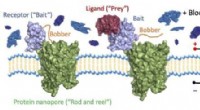
- Wetenschappers ontwikkelen moleculaire visserij om individuele moleculen in bloed te vinden
- Halfgeleiderchip die uitgeademd gas met hoge gevoeligheid bij kamertemperatuur detecteert

 Informatie over de Polar Zone
Informatie over de Polar Zone  De buitensporige gevolgen van grofheid op de werkplek
De buitensporige gevolgen van grofheid op de werkplek Wilt u niet worden getroffen door extra's op uw vlucht? Bots – en de FIU – kunnen helpen
Wilt u niet worden getroffen door extra's op uw vlucht? Bots – en de FIU – kunnen helpen  De behoefte aan elementaire wiskunde en wetenschappelijke vaardigheden in studenten
De behoefte aan elementaire wiskunde en wetenschappelijke vaardigheden in studenten
Voor studenten die een graad in de humaniora volgen, lijken wiskunde- en bètaklassen misschien vervelend afleidend, en elementaire wiskundige en wetenschappelijke v
 Wat is aanpassingstheorie?
Wat is aanpassingstheorie?  Een robot die circuits tekent met geleidende inkt om te overleven
Een robot die circuits tekent met geleidende inkt om te overleven Hoe kleine steden reageren op de wereldwijde pandemie
Hoe kleine steden reageren op de wereldwijde pandemie  Onderzoekers onthullen het oceanische zwarte koolstofputeffect, aangedreven door microdruppeltjes uit zeewater
Onderzoekers onthullen het oceanische zwarte koolstofputeffect, aangedreven door microdruppeltjes uit zeewater
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap © https://nl.scienceaq.com


