
Wetenschap
Gedragen ionische verbindingen en moleculen zich op dezelfde manier wanneer ze worden opgelost?
1. Dissociatie versus oplossing :
- Ionische verbindingen:Wanneer een ionische verbinding oplost in een oplosmiddel, dissociëren de samenstellende ionen van elkaar. De ionen worden opgelost door de oplosmiddelmoleculen, wat betekent dat oplosmiddelmoleculen deze omringen en ermee interageren.
- Moleculaire stoffen:Moleculaire stoffen dissociëren over het algemeen niet in ionen wanneer ze oplossen. In plaats daarvan solvateren de oplosmiddelmoleculen het gehele molecuul, waardoor een homogeen mengsel ontstaat.
2. Geleidbaarheid :
- Ionische verbindingen:Oplossingen van ionische verbindingen zijn goede geleiders van elektriciteit omdat de opgeloste ionen vrij kunnen bewegen onder invloed van een elektrisch veld.
- Moleculaire stoffen:Oplossingen van moleculaire stoffen zijn doorgaans slechte geleiders van elektriciteit omdat er geen vrije ionen aanwezig zijn.
3. Kookpunt en vriespunt :
- Ionische verbindingen:Oplossingen die ionische verbindingen bevatten, hebben over het algemeen hogere kookpunten en lagere vriespunten in vergelijking met zuivere oplosmiddelen. Dit effect wordt respectievelijk kookpuntverhoging en vriespuntverlaging genoemd.
- Moleculaire stoffen:Oplossingen die moleculaire stoffen bevatten, kunnen kleine veranderingen in kook- en vriespunten vertonen, maar de effecten zijn over het algemeen kleiner in vergelijking met ionische verbindingen.
4. Colligatieve eigenschappen :
- Ionische verbindingen:Ionische verbindingen dragen meerdere ionen bij aan de oplossing, wat leidt tot meer uitgesproken colligatieve eigenschappen zoals osmotische druk en verlaging van de dampdruk.
- Moleculaire stoffen:Moleculaire stoffen dragen, afhankelijk van hun grootte en concentratie, een relatief kleiner effect op de colligatieve eigenschappen bij dan ionische verbindingen.
5. Chemische reacties :
- Ionische verbindingen:Het oplossen van ionische verbindingen in bepaalde oplosmiddelen kan leiden tot chemische reacties, zoals hydrolyse in het geval van water als oplosmiddel.
- Moleculaire stoffen:Moleculaire stoffen ondergaan gewoonlijk geen chemische reacties bij oplossing in een oplosmiddel, tenzij het oplosmiddel chemisch reactief is.
Deze verschillen komen voort uit de fundamentele aard van ionische verbindingen (samengesteld uit ionen die bij elkaar worden gehouden door elektrostatische krachten) en moleculaire stoffen (covalente verbindingen die bij elkaar worden gehouden door covalente bindingen). De aanwezigheid van vrije ionen in oplossing geeft aanleiding tot de unieke eigenschappen die worden waargenomen in ionische verbindingen.
Het is belangrijk op te merken dat er uitzonderingen en variaties kunnen zijn, afhankelijk van de specifieke verbindingen, het oplosmiddel en de omstandigheden.
 Sommige atomen, zoals koolstof-14, waarvan de kernen niet stabiel zijn, verliezen delen van hun kern door verval. Tijdens het proces worden ze een ander element. Atomen zouden dit zijn?
Sommige atomen, zoals koolstof-14, waarvan de kernen niet stabiel zijn, verliezen delen van hun kern door verval. Tijdens het proces worden ze een ander element. Atomen zouden dit zijn?  Polymeerfilm beschermt tegen elektromagnetische straling, signaal interferentie
Polymeerfilm beschermt tegen elektromagnetische straling, signaal interferentie Wat is de pH van gain-wasmiddel?
Wat is de pH van gain-wasmiddel?  Waarom moeten wetenschappers ervoor zorgen dat chemische vergelijkingen in evenwicht zijn?
Waarom moeten wetenschappers ervoor zorgen dat chemische vergelijkingen in evenwicht zijn?  Een duurzamere manier om metalen te raffineren
Een duurzamere manier om metalen te raffineren
 De kou trotseren om te begrijpen wat eekhoorns drijft
De kou trotseren om te begrijpen wat eekhoorns drijft  Bescherming van de ozonlaag levert enorme gezondheidsvoordelen op
Bescherming van de ozonlaag levert enorme gezondheidsvoordelen op 300 jaar dunner worden kan ertoe hebben geleid dat Antarctische ijsplaten instorten
300 jaar dunner worden kan ertoe hebben geleid dat Antarctische ijsplaten instorten NASA analyseert zware regenval in Kammuris
NASA analyseert zware regenval in Kammuris Wat zijn de 5 kenmerken die alle levende wezens gemeen hebben?
Wat zijn de 5 kenmerken die alle levende wezens gemeen hebben?
Hoofdlijnen
- Bioloog ontdekt wat misschien wel de 'kieskeurigste' partners ter wereld zijn
- Welk enzym is verantwoordelijk voor het verlengen van de RNA-keten?
- Moleculaire genetica (biologie): een overzicht
- Coronavirus:waarom we het pandemische verbod op herbruikbare bekers moeten beëindigen
- Hoe komen virussen in cellen? Hun infectietactieken bepalen of ze over soorten heen kunnen springen of een pandemie kunnen veroorzaken
- Mysterie opgelost? Biologen vinden een unieke versie van filamentvormend eiwit in menselijke cellen die insecten niet hebben
- Kan AI bedreigde mariene soorten helpen de klimaatverandering te overleven?
- Welk deel van de plant laat voedselwater en zuurstof door?
- EU doorbreekt patstelling om licentie op controversiële onkruidverdelger te verlengen (update 3)
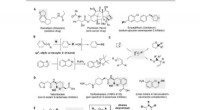
- Invoeging van boor in alkyletherbindingen via tandemkatalyse van zink/nikkel
- Machine learning voorspelt mechanische eigenschappen van poreuze materialen
- Video:Hoe drakenbloed je leven kan redden

- Een nieuw ontwerp voor flowbatterijen

- Cirkels transformeren in vierkanten:onderzoekers herconfigureren de materiaaltopologie op microschaal

 Hoe een man te onderscheiden van een vrouwelijke blauwe Jay
Hoe een man te onderscheiden van een vrouwelijke blauwe Jay Nieuw nanomateriaal voor kwantumelektronica
Nieuw nanomateriaal voor kwantumelektronica Intel Optane-geheugen H10 met solid-state opslag komt dit jaar uit
Intel Optane-geheugen H10 met solid-state opslag komt dit jaar uit Nieuw orgel-op-chip platform voor drugsscreening
Nieuw orgel-op-chip platform voor drugsscreening Onderzoekers bestuderen de complexiteit van homologe recombinatie en abnormale chromosoombruggen
Onderzoekers bestuderen de complexiteit van homologe recombinatie en abnormale chromosoombruggen  Wat is het verschil tussen LPS en SPS-koralen?
Wat is het verschil tussen LPS en SPS-koralen?  Wat is een voorbeeld van een hydroxide-ion?
Wat is een voorbeeld van een hydroxide-ion?  Hoe weet je of een zuur of base sterk zwak is?
Hoe weet je of een zuur of base sterk zwak is?
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap © https://nl.scienceaq.com

