
Wetenschap
Hoe zal radium reageren met zuurstof?
2Ra + O2 → 2RaO
Bij deze reactie verliezen radiumatomen twee valentie-elektronen aan zuurstofatomen, wat resulteert in de vorming van positief geladen radiumionen (Ra2+) en negatief geladen oxide-ionen (O2-). De elektrostatische aantrekking tussen de radium- en oxide-ionen leidt tot de vorming van een stabiele ionische verbinding, radiumoxide.
De reactie van radium met zuurstof is zeer exotherm, waarbij een aanzienlijke hoeveelheid warmte en licht vrijkomt. Dit maakt radium tot een uiterst gevaarlijk element om mee te werken, omdat het gemakkelijk kan ontbranden en brand of explosies kan veroorzaken. Radium reageert ook krachtig met water en vormt radiumhydroxide en waterstofgas.
Vanwege de hoge reactiviteit en de daarmee gepaard gaande veiligheidsrisico's wordt radium met uiterste zorg behandeld en opgeslagen in gespecialiseerde faciliteiten. Het wordt voornamelijk in kleine hoeveelheden gebruikt voor medische doeleinden, zoals bestralingstherapie, en in bepaalde industriële toepassingen, zoals radiografie en ionisatiebronnen.
 De kracht van pauze:gecontroleerde afzetting voor effectieve en langdurige organische apparaten
De kracht van pauze:gecontroleerde afzetting voor effectieve en langdurige organische apparaten  Team ontwikkelt nieuwe methode om hernieuwbaar acrylonitril te produceren
Team ontwikkelt nieuwe methode om hernieuwbaar acrylonitril te produceren Een nieuwe benadering om de katalysatoren voor de waterstofevolutiereactie te verbeteren
Een nieuwe benadering om de katalysatoren voor de waterstofevolutiereactie te verbeteren Heilige graal voor batterijen:Solid-state magnesiumbatterij een grote stap dichterbij
Heilige graal voor batterijen:Solid-state magnesiumbatterij een grote stap dichterbij Hoe handhaaft de maag de omstandigheden bij pH 2?
Hoe handhaaft de maag de omstandigheden bij pH 2?
 Blockadia-kaart onthult wereldwijde schaal van antifossiele brandstofbeweging
Blockadia-kaart onthult wereldwijde schaal van antifossiele brandstofbeweging Hoe spinnen te identificeren die in Indiana zijn gevonden
Hoe spinnen te identificeren die in Indiana zijn gevonden Nieuw rapport onderzoekt de wetenschap van interventies om koraalriffen te redden
Nieuw rapport onderzoekt de wetenschap van interventies om koraalriffen te redden Low-flow-onderzoek op de Colorado-rivier werpt licht op het uiteindelijke nieuwe normaal voor Grand Canyon
Low-flow-onderzoek op de Colorado-rivier werpt licht op het uiteindelijke nieuwe normaal voor Grand Canyon De verschillen in bossen, bossen en oerwouden
De verschillen in bossen, bossen en oerwouden
Hoofdlijnen
- Welke insecten zijn de beste bestuivers?
- Red Delicious of Wolf-appel? Braziliaanse savannevruchten met een hoog gehalte aan antioxidanten
- De soorten cellen die aan een membraan gebonden zijn Nucleus
- WAT IS DE NAAM VAN DE MAAGCEL DIE ZOUTZUUR AFSCHEIDT?
- De geplande massa-executie van ganzen in Conn. City werd stopgezet na een stortvloed aan gepassioneerde inbreng van beide kanten
- Uit onderzoek blijkt wat ervoor zorgt dat plantenwortels sterk worden
- Dankzij een krachtige nieuwe techniek kunnen wetenschappers bestuderen hoe eiwitten in cellen van vorm veranderen
- Vogelgezang en menselijke stem opgebouwd uit dezelfde genetische blauwdruk
- Waarom is water belangrijk voor het uitscheidingssysteem in het lichaam?
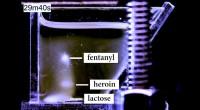
- Nieuwe technologie kan wetshandhavers helpen kleinere hoeveelheden fentanyl met een hogere mate van nauwkeurigheid te detecteren
- Video:Waarom flamingo's cooler zijn dan je denkt

- Sinaasappelschilolie opzuigen tot nieuwe, aangename aromastoffen

- Metaalschuim houdt kogels van .50 kaliber tegen, evenals staal - bij minder dan de helft van het gewicht

- Onderzoekers produceren slimme stof om zenuwgas te neutraliseren

 Onderzoek laat zien hoe consumenten afhankelijk zijn van de prijs om de kwaliteit van producten te bepalen
Onderzoek laat zien hoe consumenten afhankelijk zijn van de prijs om de kwaliteit van producten te bepalen  Natuur-imiterende coating maakt batterijen duurzamer en efficiënter
Natuur-imiterende coating maakt batterijen duurzamer en efficiënter Expert bespreekt waarom de gasprijzen nog steeds hoog zijn ondanks het feit dat olie goedkoper wordt, en wat er daarna gaat gebeuren
Expert bespreekt waarom de gasprijzen nog steeds hoog zijn ondanks het feit dat olie goedkoper wordt, en wat er daarna gaat gebeuren Spaghetti, vensterbank, en LEGO:on-the-fly composieten modellering
Spaghetti, vensterbank, en LEGO:on-the-fly composieten modellering Het gebruik van reinigingstechnologieën optimaliseren
Het gebruik van reinigingstechnologieën optimaliseren Wat drijft mensen op het gebied van milieu?
Wat drijft mensen op het gebied van milieu?  Biohybride microrobots kunnen micro- en nanoplastics uit aquatische omgevingen verwijderen
Biohybride microrobots kunnen micro- en nanoplastics uit aquatische omgevingen verwijderen  Huawei plant juridische uitdaging tegen de laatste Amerikaanse druk:rapport
Huawei plant juridische uitdaging tegen de laatste Amerikaanse druk:rapport
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap © https://nl.scienceaq.com

