
Wetenschap
Team verlicht de micro-omgeving, een nieuwe weg naar kankermedicijnen creëren
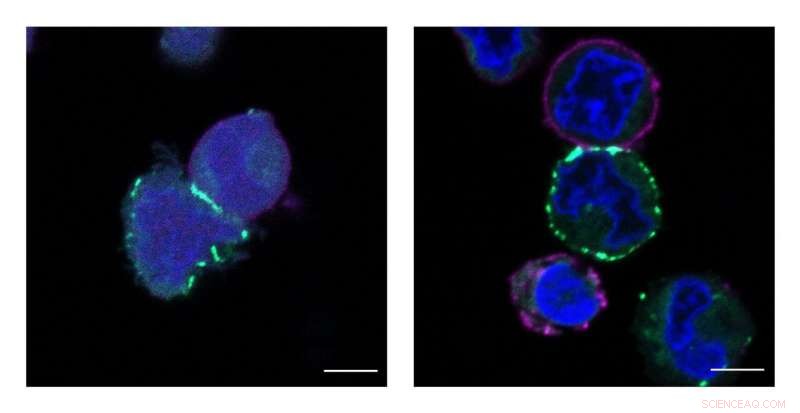
Princeton's MacMillan Group ontwikkelde een nieuwe technologie genaamd μMap die de naaste buren van eiwitten op celoppervlakken identificeert. Deze afbeeldingen tonen cellen die worden gelabeld, of groen gemarkeerd, door de μMap-katalysator. Krediet:Tamara Reyes-Robles/Merck verkennend wetenschapscentrum
Toen zakelijke partners in het Princeton Catalysis Initiative twee jaar geleden met David MacMillan om tafel gingen, ze stelden hem voor een biologische uitdaging in het hart van potentiële kankermedicijnen en andere therapieën:welke eiwitten op het celoppervlak raken elkaar?
Wat ze wilden was analoog aan een zoeklicht dat in een donkere grot brandde - iets om een metaforisch licht te laten schijnen op een eiwit en zijn naaste buren op het celmembraan. Groot, complexe moleculen, eiwitten zijn de dingen van het leven, het steunpunt waarop alles om ons heen draait - de manier waarop we denken, de manier waarop we groeien, de ziekten die we krijgen. Eiwitten kunnen dit bepalen door berichten naar hun buren te sturen. Maar terwijl wetenschappers eerder konden zien wie er in de grot was, ze konden niet zien wie naast wie stond, en dus ontbrak het aan belangrijke kennis over deze essentiële eiwit-naar-eiwit-communicatie.
De MacMillan Group van het Department of Chemistry kondigde in het huidige nummer van Wetenschap dat ze dat zoeklicht hebben ontwikkeld.
De baanbrekende technologie, genaamd μMap door het team van Princeton-onderzoekers en Merck-wetenschappers, maakt gebruik van een fotokatalysator - een molecuul dat, wanneer geactiveerd door licht, spoort een chemische reactie aan - om ruimtelijke relaties op celoppervlakken te identificeren. De katalysator genereert een marker die eiwitten en hun moleculaire buren tagt, wat op zijn beurt het nauwkeurig in kaart brengen van hun micro-omgeving mogelijk maakt.
De technologie kan van invloed zijn op proteomics, genomica en neurowetenschappen, om een paar van de meer voor de hand liggende velden te noemen. Maar de toepassingen voor fundamentele biologie zijn zo breed dat MacMillan, wie is James S. McDonnell Distinguished University Professor of Chemistry van Princeton, heeft honger om de technologie "in ieders handen" te krijgen om te zien wat wetenschappers op andere gebieden kunnen bedenken.
"Voor de technologieën die we nu hebben, het probleem is niet of je dingen kunt taggen, ' zei hij. 'Het probleem is dat je duizenden dingen kunt labelen en dus niet kunt zien wat daar verderop is en wat er vlak naast de deur is. Dat blijkt echt heel belangrijk omdat moleculen of eiwitten of enzymen die elkaar signaleren meestal naast elkaar liggen. We zullen, de state-of-the-art vertelt je niet wat er dichtbij is."
Dus bedachten ze een radicaal nieuwe aanpak.
"We hebben een aantal kritische experimenten gedaan en we konden meteen aantonen dat we dingen op een heel korte afstand labelden, "Zei MacMillan. "We weten nu precies wat er in de buurt is. En dat is nog nooit eerder gedaan. voor biologie, het zal zijn alsof je de lichtschakelaar aanzet en plotseling alles ziet."
Merck Exploratory Science Center (MESC) wetenschappers Rob Oslund en Olugbeminiyi Fadeyi, paper co-auteurs die zijn gevestigd in Cambridge, Massachusetts, zei dat de technologie enorme nieuwe ontwikkelingen in de biologie zou kunnen inspireren. "Gezien de belangrijke rol van het begrijpen van eiwitinteracties binnen cellulaire micro-omgevingen, "Olund zei, "Deze technologie heeft het potentieel om een baanbrekende tool te zijn voor zowel academische als industriële biowetenschappelijke laboratoria over de hele wereld."
De μKaart, uitgesproken microkaart, identificeert buren binnen een straal van 1 tot 10 nanometer rond een bepaald eiwit. (Als referentie, een mensenhaar is ongeveer 100, 000 nanometer breed.) Resolutie op dit niveau identificeert de 10 of 15 dichtstbijzijnde moleculen.
Jacob Ger, een postdoctoraal onderzoeker in het Merck Center for Catalysis aan de Princeton University en een co-first-auteur van de Wetenschap paper met afgestudeerde student James Oakley en MESC-wetenschapper Tamara Reyes-Robles, zei μMap doet dit door blauw licht te gebruiken om een katalytische reactie aan te drijven.
Zo werkt het:De katalysator, in dit geval een organische metaalverbinding - wordt selectief gehecht aan een van de ongeveer 40, 000 eiwitten op het celoppervlak, waar het als een soort antenne fungeert. Blauw licht, die een zeer hoge fotonische energie heeft, dient als trekker. Toen scheen op de cel, dit blauwe licht wordt opgevangen door de antenne, die zijn fotonische energie omzet in chemische energie. Die latente energie koelt niet; het verspreidt niet; het dwaalt niet doelloos langs het celmembraan en schildert alles wat het tegenkomt. Het zit gewoon.
Op basis van een artikel dat zo'n 40 jaar geleden werd gepubliceerd, De groep van MacMillan kwam op het idee om gebruik te maken van een organisch molecuul, diazirine genaamd, dat bijzonder ontvankelijk is voor deze latente energie. Wanneer een diazirine heel dicht bij de katalysator komt - binnen 0,1 nanometer - wordt de chemische energie overgedragen naar de diazirine. De diazirine reageert op zijn beurt zo heftig dat het een bijproduct vrijgeeft en wordt wat een carbeen wordt genoemd, een "boze" soort die zich hecht aan naburige eiwitten.
"De katalysator brengt zoveel energie over dat het molecuul zichzelf uit elkaar scheurt om een ongelooflijk onstabiel koolstofatoom bloot te leggen, die dan gewoon blijft bij alles wat het kan, ’ legde Geri uit.
De katalysator kan deze chemische reactie vele malen uitvoeren, dus het proces herhaalt zich voor alle gelokaliseerde moleculen, eiwitten en enzymen. Omdat carbenen zo kort leven - slechts een paar nanoseconden - zorgt hun reactie voor een levendige, real-time snapshot van alle aangrenzende moleculen. Vervolgens, researchers can quilt together a precise map of the micro-environment—the very technology scientists were looking for.
"A lot of the mechanism of disease takes place through how these cells talk to each other, and they can only talk if they're touching, " said Geri. "That's why the surface of the cell is so important. If they touch, they can communicate."
He added:"We can now figure out what's making that communication happen or what's making that communication change. It's really been an amazing experience, working on this."
MacMillan's group chose two categories of human cells to investigate. One was a class of proteins that had known interactions, selected as a kind of control group to prove that their interactions could be captured by μMap. The second group was "more interesting, " said Geri. It centered on proteins called PD-L1 and PD-1, which are associated with the body's immune system and its response to cancer cells.
Normaal gesproken, sick cells like cancer cells would present as molecular interlopers that need to be cleared by the immune system. But cancer cells are deceptive, said MacMillan. They send out a "don't kill me" signal through a cloaking mechanism involving the PD-L1 and PD-1 axis. Since cancer therapies are successful partly based on their capacity to block that signal, scientists want to know more about how it is transmitted. Mapping the precise neighborhood is an essential early step. When researchers put the μMap catalyst on PD-L1 and PD-1, the molecules in their micro-environment are tagged. Protein-protein interactions that had previously been hypothesized could now be directly observed. And several correlations were detected that had never been conceived of.
"Nutsvoorzieningen, we don't do the cancer biology, " said MacMillan. "But we've invented this tool that can give you a lot of information about these cancer cells. We think that by using this information, you can start to target those proteins as a way to also remove interfering signals. And if you can remove those signals, you make your immune system better at going after these cancer cells."
Soon after MacMillan arrived at Princeton, he began driving research in harnessing blue LED light to perform previously impossible feats of chemistry. Merck became involved in 2006, with a seed donation toward MacMillan's research. The company has since donated additional monies, and in 2019 they announced a 10-year funding commitment towards the Princeton Catalysis Initiative, which fosters interdisciplinary collaborations to accelerate the discovery of new research areas.
"Our collaboration created a novel cellular chemistry approach leveraging photoredox catalysis to activate diazirines, an important class of organic molecules, in a temporal-controlled manner, " said Merck's Fadeyi. "Because of the routine use of diazirines within chemical biology and biology, this method will be in high demand not only for protein labeling, but for identifying the binding targets of other biomolecules to elucidate their functional roles."
He added:"The collaboration was successful due to the close interactions between Merck scientists and Dave's lab."
MacMillan likewise lauded the discovery as proof of the value of collaboration across academic and industry lines, like those envisioned when the Princeton Catalysis Initiative first came into being in 2018.
"Als chemici, we don't know any good questions in biology—zero, "zei hij. "Dus, you're taking these people who know everything about biology, and they have this problem that they're trying to solve. And it's ultimately a great problem for a chemistry group. Tegelijkertijd, it's not a problem that a chemistry group would ever think about because they don't know biology. You have these two different areas and you put them together and you start to realize there all these great things you can do.
"This is what I love about the social science of science, " he added. "It is absolutely a beautiful example of how it took a village to solve a problem."
 Wat is het moeilijkst bekende metaal?
Wat is het moeilijkst bekende metaal?  Moleculaire machine maakt gebruik van beweging in één richting
Moleculaire machine maakt gebruik van beweging in één richting NIST dringt aan op voorzichtigheid bij het gebruik van bewijsmateriaal in de rechtszaal
NIST dringt aan op voorzichtigheid bij het gebruik van bewijsmateriaal in de rechtszaal Waardoor ontstaat die piek? Een al lang bestaande vraag over covalente vloeistoffen beantwoorden
Waardoor ontstaat die piek? Een al lang bestaande vraag over covalente vloeistoffen beantwoorden Hoe de geleidbaarheid in water te meten
Hoe de geleidbaarheid in water te meten
 Modellering van de impact van veranderende neerslagpatronen in Noord-Europese en Noord-Amerikaanse steden
Modellering van de impact van veranderende neerslagpatronen in Noord-Europese en Noord-Amerikaanse steden Van sprinkhanen tot branden, landbouw wordt geconfronteerd met toenemende bedreigingen:VN
Van sprinkhanen tot branden, landbouw wordt geconfronteerd met toenemende bedreigingen:VN Lokale inspanningen om koraalriffen te redden zullen niet genoeg zijn, studie suggereert:
Lokale inspanningen om koraalriffen te redden zullen niet genoeg zijn, studie suggereert: Wat gebeurt er in Vegas, misschien uit het noordpoolgebied komen?
Wat gebeurt er in Vegas, misschien uit het noordpoolgebied komen? NASA-NOAA-satelliet ziet aan land vallende orkaan Florence
NASA-NOAA-satelliet ziet aan land vallende orkaan Florence
Hoofdlijnen
- Rapport identificeert manieren om de commerciële vissersvloot van Alaska te verjongen
- Boot die Steinbeck naar de Zee van Cortez bracht wordt gerestaureerd
- Charles Lyell: Biography, Theory of Evolution & Facts
- Klimaatveranderingen verkorten de mariene voedselketen voor de kust van Californië
- Onderzoeksartikelen werpen licht op een decennium lang stamcelmysterie
- Nieuwe oude dolfijnsoort Urkudelphis chawpipacha ontdekt in Ecuador
- Gemuteerd kikkergen stoot roofdieren af
- Hoe is de concentratie van een oplossing van invloed op osmose?
- Tornado's Effecten op mensen
- Onderzoekers onthullen verborgen genetische regels voor hoe het leven op aarde begon

- Nieuwe strategie verbetert de stabiliteit van metaalkatalysatoren uit de platinagroep

- Wetenschappers synthetiseren loodvrije op zirkonium gebaseerde vacature-geordende dubbele perovskiet nanokristallen
- Tweetraps gassensorrapporten over bodemdynamiek

- Herstellen van actief pompend hartweefsel met op mosselen geïnspireerde weefsellijm

 Hoe een Zenerdiode te gebruiken om DC-spanning te verlagen
Hoe een Zenerdiode te gebruiken om DC-spanning te verlagen Het VK kent een grotere regionale ongelijkheid dan enig ander groot welvarend land
Het VK kent een grotere regionale ongelijkheid dan enig ander groot welvarend land Moleculaire kooien bouwen om ziekten te bestrijden
Moleculaire kooien bouwen om ziekten te bestrijden Afzijdige neutronen kunnen in feite kort met elkaar praten in een nieuw soort symmetrie
Afzijdige neutronen kunnen in feite kort met elkaar praten in een nieuw soort symmetrie Lucht-zeekoppeling verbetert de simulatie van de westelijke zomermoesson in de noordelijke Stille Oceaan
Lucht-zeekoppeling verbetert de simulatie van de westelijke zomermoesson in de noordelijke Stille Oceaan Metaalcomplexen gemaakt van cyclische moleculen
Metaalcomplexen gemaakt van cyclische moleculen Onderzoekers ontdekken dat bellen de energieoverdracht versnellen
Onderzoekers ontdekken dat bellen de energieoverdracht versnellen Genderdiversiteit is gekoppeld aan onderzoeksdiversiteit
Genderdiversiteit is gekoppeld aan onderzoeksdiversiteit
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Portuguese | Swedish | German | Dutch | Danish | Norway | Spanish |

-
Wetenschap © https://nl.scienceaq.com

