
Wetenschap
Waarom is de relativiteitstemittiviteit van Germanium groter dan de diamant?
Dit is de reden waarom de relatieve permittiviteit van Germanium groter is dan die van Diamond:
* Atomische structuur en binding:
* diamant: Diamond heeft een zeer rigide, strak gepakte structuur met sterke covalente bindingen tussen zijn koolstofatomen. Deze strakke binding vermindert het vermogen van elektronen om te verschuiven in reactie op een elektrisch veld, wat resulteert in een lagere diëlektrische constante.
* germanium: Germanium heeft een grotere atoomradius en zwakkere covalente bindingen in vergelijking met diamant. Deze lossere structuur zorgt voor een grotere elektronenverplaatsing in reactie op een elektrisch veld, wat leidt tot een hogere diëlektrische constante.
* Elektronische bandstructuur:
* diamant: Diamond heeft een grote bandspleet, wat betekent dat er veel energie voor nodig is om elektronen van zijn valentieband op te wekken naar zijn geleidingsband. Dit maakt het een goede isolator en draagt bij aan zijn lagere diëlektrische constante.
* germanium: Germanium heeft een kleinere band kloof in vergelijking met diamant, waardoor elektronen gemakkelijker kunnen worden opgewonden in de geleidingsband. Dit draagt bij aan zijn hogere diëlektrische constante.
Samenvattend: De grotere atoomradius, zwakkere bindingen en kleinere bandafstand van Germanium zorgen voor een grotere elektronenmobiliteit en polarisatie in een elektrisch veld, wat resulteert in een hogere relatieve permittiviteit in vergelijking met diamant.
Hoofdlijnen
- Wat gebeurt er met planten en dierlijke cellen bij plaatsing in hypertonische, hypotone en isotone omgevingen?
- Hoe helpen bloemen planten zich voort te planten?
- Welke rol speelt cytokinese tijdens de celcyclus?
- Wat is vergelijkende biochemie?
Vergelijkende biochemie kan een vaag begrip zijn met meerdere betekenissen, alhoewel het boeiende interacties tussen organismen en hun biologieën kan onthullen. Op zijn minst noemen wetenschappers het een interdiscip
- Wat is de tweede stap van eiwitsynthese?
- Stadia van ecologische successie
- Wat is fysieke barrières van Biomes?
- Hoe passen sommige cellen in bladeren en wortels zich aan aan hun werk?
- Groep organen wordt een genoemd?
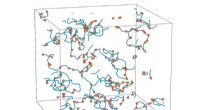
- Onderzoekers vergroten het begrip van vortex-verspreiding in supervloeistoffen
- Waterdruppels worden hydrobots door magnetische kralen toe te voegen

- Waarom is de LHC 27 kilometer in omtrek?

- Een 150 jaar oude regel voor fasegedrag trotseren

- Natuurkundigen mengen klassiek licht met een half foton op een qubit
 UITLEG:Wat zit er achter de hittegolf in het Amerikaanse Westen?
UITLEG:Wat zit er achter de hittegolf in het Amerikaanse Westen?  Op drones gebaseerd systeem voor vroege detectie om veranderingen in de Amazone te volgen
Op drones gebaseerd systeem voor vroege detectie om veranderingen in de Amazone te volgen Hoe cellen leren 'tellen'
Hoe cellen leren 'tellen'  Een effectieve strategie voor het beschermen van skyrmionen in kwantumcomputers
Een effectieve strategie voor het beschermen van skyrmionen in kwantumcomputers Waarom kunnen we de kraters van de maan zo duidelijk van de aarde zien?
Waarom kunnen we de kraters van de maan zo duidelijk van de aarde zien?  Wat is het wetenschapsgebied dat onderzoeksplaneten en de ruimte omvat?
Wat is het wetenschapsgebied dat onderzoeksplaneten en de ruimte omvat?  IJsland:verdachte van Bitcoin-roof is waarschijnlijk naar Zweden gevlucht
IJsland:verdachte van Bitcoin-roof is waarschijnlijk naar Zweden gevlucht Een microfluïdisch systeem met celscheidende krachten kan ontrafelen hoe nieuwe ziekteverwekkers aanvallen
Een microfluïdisch systeem met celscheidende krachten kan ontrafelen hoe nieuwe ziekteverwekkers aanvallen
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap © https://nl.scienceaq.com


