
Wetenschap
Hoe kunt u dit verschil verklaren dat het element boor een atomaire massa van 10.81amu heeft die naar het periodieke tabel is, geen enkele atoom precies 10.81amu?
isotopen en gemiddelde atoommassa:
* isotopen: Elementen kunnen bestaan in verschillende vormen die isotopen worden genoemd. Isotopen van hetzelfde element hebben hetzelfde aantal protonen (het element definiëren) maar verschillende aantallen neutronen. Dit betekent dat ze iets verschillende massa's hebben.
* Borons isotopen: Boron heeft twee hoofdisotopen:boron-10 en boron-11. Boron-10 heeft 5 protonen en 5 neutronen, terwijl boor-11 5 protonen en 6 neutronen heeft.
* Gemiddelde atoommassa: De atomaire massa op het periodiek systeem is het * gewogen gemiddelde * van de massa van alle natuurlijk voorkomende isotopen van een element. De weging is gebaseerd op de relatieve overvloed van elke isotoop.
Voorbeeld:
Stel je voor dat je 100 booratomen hebt. Laten we zeggen dat 20 van hen boor-10 (massa ~ 10 amu) zijn en 80 zijn boor-11 (massa ~ 11 amu). Om de gemiddelde atoommassa te berekenen:
1. Vermenigvuldig de massa van elke isotoop met zijn overvloed:
* Boron-10:(20/100) * 10 amu =2 amu
* Boron-11:(80/100) * 11 AMU =8.8 AMU
2. Voeg de resultaten toe:2 AMU + 8.8 AMU =10.8 AMU
Samenvattend:
* De atoommassa op het periodiek systeem vertegenwoordigt de gemiddelde massa van alle booratomen die in de natuur worden gevonden.
* Geen enkel booratoom heeft een massa van 10,81 AMU omdat het een gewogen gemiddelde is van de massa's van de verschillende isotopen.
 Wat zijn de producten van een chemische reactie?
Wat zijn de producten van een chemische reactie?  Hoeveel atomen in 1 gram plutonium?
Hoeveel atomen in 1 gram plutonium?  Ontwikkelingen op het gebied van dubbelatomige katalysatoren maken hernieuwbare energiebronnen efficiënter
Ontwikkelingen op het gebied van dubbelatomige katalysatoren maken hernieuwbare energiebronnen efficiënter  Minimaliseren van thermische geleidbaarheid van kristallijn materiaal met optimale nanostructuur
Minimaliseren van thermische geleidbaarheid van kristallijn materiaal met optimale nanostructuur Bacteriën maken spijkerbroek groen
Bacteriën maken spijkerbroek groen
 Eilanden in de lucht:hoe geïsoleerd zijn plantenpopulaties op bergtoppen?
Eilanden in de lucht:hoe geïsoleerd zijn plantenpopulaties op bergtoppen?  Waarschuwing voor dodelijke microben water opgeheven voor iedereen behalve 1 stad in Texas
Waarschuwing voor dodelijke microben water opgeheven voor iedereen behalve 1 stad in Texas Waarom de klimaatverandering sommigen ertoe aanzet geen kinderen te krijgen
Waarom de klimaatverandering sommigen ertoe aanzet geen kinderen te krijgen  Verbazingwekkende koeien zijn veelbelovend in baanbrekende duurzame voedselsystemen van de toekomst
Verbazingwekkende koeien zijn veelbelovend in baanbrekende duurzame voedselsystemen van de toekomst Myanmar-onderneming probeert afval trendy te maken
Myanmar-onderneming probeert afval trendy te maken
Hoofdlijnen
- Bevordering van de veerkracht van fruitgewassen:onthulling van de moleculaire dynamiek van abscissie in houtachtige fruitgewassen
- Wat zijn de 6 Kindoms in de wetenschap?
- Over hoeveel verschillende soorten organismen hebben wetenschappers tot nu toe ontdekt?
- Ideeën voor de dingen Kinderen kunnen met een microscoop bekijken
Kinderen zijn vaak nieuwsgierig naar de wereld om hen heen. Een manier om deze nieuwsgierigheid aan te moedigen, is om ze een manier te bieden om de natuur op een nieuwe en intensiev
- Alle lichaamsorganen zijn van vitaal belang voor het leven of onwaar?
- Welke virus infecteren bacteriën?
- Wat is de bijnaam voor mitochondria?
- Hormonen die calcium en fosfaat reguleren Homeostase
- Methode maakt inzichtelijk wat bacteriën in hun omgeving waarnemen
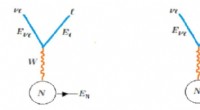
- Onderzoek naar hoogenergetische neutrino's geassocieerd met een blazar
- Onderzoekers ontdekken een economische manier om hoogwaardige dunne films voor elektronica te produceren
- Begrijpen hoe lijndiktes in microkammen nauwkeurigere metingen mogelijk maken

- Fluctuerende omgevingen kunnen samenwerkende bacteriën helpen

- Een nieuw soort vuur, de brandstof van de toekomst?

 Hoe het punt van discontinuïteit te vinden in Algebra II
Hoe het punt van discontinuïteit te vinden in Algebra II  Twee factoren die invloed hebben op de zwaartekracht van een object
Twee factoren die invloed hebben op de zwaartekracht van een object  Onderzoekers creëren een stabiele hybride laser door micro-optica in 3D op vezels te printen
Onderzoekers creëren een stabiele hybride laser door micro-optica in 3D op vezels te printen  Onderzoeken hoe de convergentie van automatisering en AI het onderzoek naar de organische chemie opnieuw vormgeeft
Onderzoeken hoe de convergentie van automatisering en AI het onderzoek naar de organische chemie opnieuw vormgeeft  Wat is de klasse van hibiscusplanten?
Wat is de klasse van hibiscusplanten?  Hoe converteer je koolzuur in alcohol?
Hoe converteer je koolzuur in alcohol?  Wat is het proces van het scheiden van chemicaliën in een medicijn?
Wat is het proces van het scheiden van chemicaliën in een medicijn?  Berekeningen laten zien dat Ia supernova detecteerbaar moet zijn met neutrino's, wat de mogelijkheid biedt om het explosietype te identificeren
Berekeningen laten zien dat Ia supernova detecteerbaar moet zijn met neutrino's, wat de mogelijkheid biedt om het explosietype te identificeren
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap © https://nl.scienceaq.com

