
Wetenschap
Hoe vind je het massa -nummer van een element?
Hier is een uitsplitsing:
* protonen: Dit zijn positief geladen deeltjes gevonden in de kern van een atoom. Het aantal protonen bepaalt het atoomnummer van het element.
* neutronen: Dit zijn neutrale deeltjes (geen lading) die ook in de kern worden gevonden.
* elektronen: Dit zijn negatief geladen deeltjes die de kern draaien. Hun aantal is meestal gelijk aan het aantal protonen in een neutraal atoom.
Voorbeeld:
* koolstof (c) Heeft een atoomnummer van 6, wat betekent dat het 6 protonen heeft.
* Een typisch koolstofatoom heeft ook 6 neutronen.
* Daarom is het massale aantal koolstof 6 (protonen) + 6 (neutronen) = 12 .
Sleutelpunten:
* Massienummer is een heel getal. Het wordt vaak geschreven als een superscript links van het symbool van het element (bijv. ¹²C).
* Massienummer kan variëren voor hetzelfde element. Dit komt door de aanwezigheid van isotopen, die atomen van hetzelfde element zijn met verschillende aantallen neutronen. Carbon-12 (¹²C) en koolstof-14 (¹⁴C) zijn bijvoorbeeld beide isotopen van koolstof.
Laat het me weten als je meer voorbeelden wilt doorlopen!
 Oogsten van microdeeltjes uit een vloeistofstraal
Oogsten van microdeeltjes uit een vloeistofstraal Is HP -inktverf of op pigment gebaseerd?
Is HP -inktverf of op pigment gebaseerd?  Nobelprijs Scheikunde:Grote onderscheiding voor moleculaire zaken
Nobelprijs Scheikunde:Grote onderscheiding voor moleculaire zaken Niet-gechloreerde, met oplosmiddel verwerkte hoogwaardige ambipolaire transistors
Niet-gechloreerde, met oplosmiddel verwerkte hoogwaardige ambipolaire transistors Vastleggen van het gedrag van katalysatoren met één atoom onderweg
Vastleggen van het gedrag van katalysatoren met één atoom onderweg
 Studie werpt nieuw licht op de manier waarop Schotse bevers omgaan met het milieu
Studie werpt nieuw licht op de manier waarop Schotse bevers omgaan met het milieu  Lava spuit voor de tweede dag uit de IJslandse vulkaan terwijl de kloof zich 3,2 kilometer uitstrekt
Lava spuit voor de tweede dag uit de IJslandse vulkaan terwijl de kloof zich 3,2 kilometer uitstrekt  Tropisch fruit is kwetsbaar voor klimaatverandering. Kunnen we ze op tijd veerkrachtig maken?
Tropisch fruit is kwetsbaar voor klimaatverandering. Kunnen we ze op tijd veerkrachtig maken?  Hoe verschilt een tropisch droog klimaat van het natte klimaat?
Hoe verschilt een tropisch droog klimaat van het natte klimaat?  Nieuw beleidsontwerp nodig om wereldwijde bedreiging van het milieu aan te pakken, volgens rapport
Nieuw beleidsontwerp nodig om wereldwijde bedreiging van het milieu aan te pakken, volgens rapport
Hoofdlijnen
- Kiemvrije diermodellen onthullen de rol van darmbacteriën in de gezondheid
- Zijn eicellencellen haploïd of diploïd?
- Wat veroorzaakt gisting?
- Hoe marketinglessen kunnen voorkomen dat 'lelijke producten' voedselverspilling worden
- Waar leven zakzwammen?
- Wanneer ziektekiemen het lichaam binnengaan, wat zijn antilichamen geproduceerd door?
- Welke organellen zouden gevonden kunnen worden in een cel die zowel eukaryoot als autotroof was?
- Team ontwikkelt technologie voor de productie van bioplastics uit landbouw- en voedselbijproducten
- Wat doet Amylase?
- Wetenschappers reproduceren de dynamiek achter astrofysische schokken

- Kwantummechanica laat de olie-industrie de belofte van herstelexperimenten weten voordat ze beginnen
- Nooit eerder vertoonde topologische solitonen experimenteel gerealiseerd in vloeibare kristallen
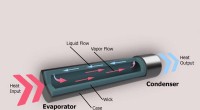
- Wickless heatpipes:nieuwe dynamiek zichtbaar in een bijna gewichtloze omgeving
- Ultrasnelle en breedband perovskiet-fotodetectoren voor beeldvorming met groot dynamisch bereik

 Wat gebeurt er met de moleculen van de meeste stoffen als ze worden verwarmd?
Wat gebeurt er met de moleculen van de meeste stoffen als ze worden verwarmd?  Verschil tussen tropisch groenblijvend en moessonbos?
Verschil tussen tropisch groenblijvend en moessonbos?  Nieuw onderzoek beschrijft hoe groot wild de lente groen volgt
Nieuw onderzoek beschrijft hoe groot wild de lente groen volgt  Hoe klimaatwetenschap te onderwijzen
Hoe klimaatwetenschap te onderwijzen  Wanneer begon de tijd volgens de theorie?
Wanneer begon de tijd volgens de theorie?  Wetenschappers ontwikkelen supersnel opladen, kaliumbatterijen met hoge capaciteit
Wetenschappers ontwikkelen supersnel opladen, kaliumbatterijen met hoge capaciteit Veel planetenstelsels verdampen voortijdig in de lucht
Veel planetenstelsels verdampen voortijdig in de lucht Koolstofrijke hete bel gedetecteerd in de planetaire nevel NGC 5189
Koolstofrijke hete bel gedetecteerd in de planetaire nevel NGC 5189
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap © https://nl.scienceaq.com

