
Wetenschap
Hoe zullen elektronenparen zich in vsepr op elkaar gedragen?
1. De enige afstoting van het paarlange paar is het sterkst: Eenzame paren, dichter bij het centrale atoom, ervaren de sterkste afstoting. Dit komt omdat ze niet worden gedeeld met een ander atoom en zich sterker aangetrokken voelen tot de kern.
2. Eenzame paarbindingspaar afstoting is tussenliggend: Eenzame paren die bindparen sterker afstoten dan bindingsparen die elkaar afstoten. Dit komt omdat de elektronendichtheid van het eenzame paar dichter bij het centrale atoom wordt geconcentreerd, terwijl de elektronen van het bindpaar tussen twee atomen worden verspreid.
3. Bonding pair-bonding paar afstoting is het zwakst: Bonding paren, gedeeld tussen twee atomen, ervaren de zwakste afstoting. Dit komt omdat de elektronendichtheid wordt verspreid over een groter gebied.
gevolgen van afstoting van elektronenparen:
* Moleculaire vorm: De afstoting tussen elektronenparen dwingt het molecuul om een specifieke vorm aan te nemen die deze afstotingen minimaliseert. In methaan (CH4) stoten de vier bindingsparen elkaar gelijkelijk af, wat resulteert in een tetraëdrische vorm.
* Bindhoeken: De hoeken tussen bindingen worden ook beïnvloed door de sterkte van de afstoting tussen elektronenparen. Bijvoorbeeld, in water (H2O), stoten de twee alleenstaande paren op het zuurstofatoom de twee bindingsparen af, waardoor de H-O-H-bindingshoek wordt gecomprimeerd tot 104,5 graden.
* Hybridisatie: In sommige gevallen kan de afstoting tussen elektronenparen leiden tot de hybridisatie van atomaire orbitalen, waarbij orbitalen van verschillende vormen en energieën mengen om nieuwe hybride orbitalen te vormen die stabieler zijn.
Samenvattend: Elektronenparen in de VSEPR -theorie gedragen zich als geladen objecten en afstoten elkaar om hun interacties te minimaliseren. De relatieve sterkte van deze afstotingen bepaalt de vorm van het molecuul en de hoeken tussen zijn bindingen.
 Welke staat heeft de hoogste bomen ter wereld?
Welke staat heeft de hoogste bomen ter wereld?  Duurzaamheid belangrijk voor internationale toeristen - nieuw onderzoek
Duurzaamheid belangrijk voor internationale toeristen - nieuw onderzoek Wat is een abstract zelfstandig naamwoord voor verkennen?
Wat is een abstract zelfstandig naamwoord voor verkennen?  Aanpassingen van apen voor de Jungle
Aanpassingen van apen voor de Jungle Droogte boven zuidwestelijk Tibetaans plateau veroorzaakt door opwarming van de oceaan met meer dan 10, 000 mijl afstand
Droogte boven zuidwestelijk Tibetaans plateau veroorzaakt door opwarming van de oceaan met meer dan 10, 000 mijl afstand
Hoofdlijnen
- Is het gepast om het dominante allel voor een recessief te plaatsen bij het bepalen van het genotype?
- Welk proces gebruikt wetenschappers om vragen over de wereld te beantwoorden?
- Anafase: wat gebeurt er in dit stadium van mitose en meiose?
- Wat doodt de Minnesota-eland? Onderzoekers lanceren nieuwe inspanningen om erachter te komen
- Waarom wordt het keelholte als onderdeel van het spijsverteringssysteem beschouwd, hoewel het voedsel niet verteert of absorbeert?
- Wat voor soort spinachtige is parasitair en kan worden gevonden bij mensen?
- Gesynchroniseerd:hoe cellen verbindingen maken, kan van invloed zijn op het circadiane ritme
- Welke functionele groep wordt altijd aangetroffen in aminozuren?
- Genetisch gewijzigde zalm? Daar stopt het niet
- Onderzoekers observeren stationaire Hawking-straling in een analoog zwart gat

- Surfen op golven in een eendimensionale kwantumvloeistof
- Boor-kwantumstippen die grafeen overtreffen met uitstekende thermische eigenschappen
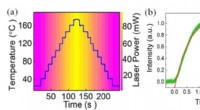
- Onderzoekers voeren eenvoudige berekeningen uit door lichtpatronen door een doorschijnende kubus te laten schijnen

- Onderzoekers ontdekken snelkoppeling naar op satellieten gebaseerd kwantumversleutelingsnetwerk

 Hoe de visuele perceptie van vogels de evolutie van bloemen beïnvloedt
Hoe de visuele perceptie van vogels de evolutie van bloemen beïnvloedt  Genetici ontdekken twee verschillende manieren om transcriptie te beëindigen
Genetici ontdekken twee verschillende manieren om transcriptie te beëindigen Wat is maanregoliet?
Wat is maanregoliet?  Nevelhypothese
Nevelhypothese  Was de aardbeving in Cascadia in 1700 onderdeel van een reeks aardbevingen?
Was de aardbeving in Cascadia in 1700 onderdeel van een reeks aardbevingen?  Wat is hoogte?
Wat is hoogte?  Onderzoekers ontwikkelen nieuwe realtime bodemnitraatsensor
Onderzoekers ontwikkelen nieuwe realtime bodemnitraatsensor Belang van weerinstrumenten
Belang van weerinstrumenten
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap © https://nl.scienceaq.com

