
Wetenschap
4 Wat gebeurt er als u het oppervlak van reactanten verhoogt in een reactie?
* Meer contactpunten: Wanneer u het oppervlak verhoogt, maakt u meer punten waar de reactanten met elkaar in contact kunnen komen. Hierdoor kunnen meer botsingen plaatsvinden tussen de reactant -moleculen.
* Verhoogde frequentie van botsingen: Meer botsingen betekenen een hogere kans dat de moleculen zullen botsen met voldoende energie om de activeringsenergiebarrière te overwinnen en producten te vormen.
* snellere reactiesnelheid: Het algemene effect is dat de reactie sneller verloopt.
Voorbeelden:
* brandend hout: Een stapel houten chips zal sneller branden dan een enkel boomstam omdat de chips een veel groter oppervlak hebben dat aan de lucht wordt blootgesteld.
* Oplost van suiker: Suikerblokjes duren langer om op te lossen in water dan kristalsuiker omdat de kubussen minder oppervlakte -oppervlak hebben blootgesteld.
* katalysatoren: Katalysatoren werken door een oppervlak te bieden met een hoog oppervlak voor reactanten om te interageren, waardoor de reactie wordt versneld.
Uitzonderingen:
Er zijn situaties waarin het toenemende oppervlak de reactiesnelheid mogelijk niet verhoogt of zelfs verlaagt. Dit kan optreden als:
* De reactie is al erg snel.
* De reactie wordt beperkt door andere factoren, zoals de beschikbaarheid van een reactant in oplossing.
* Het verhoogde oppervlak leidt tot ongewenste zijreacties.
Over het algemeen is het vergroten van het oppervlak van reactanten een veel voorkomende strategie voor het versnellen van chemische reacties.
 Studie analyseert de sleutels tot fragmentatie van metalen materialen
Studie analyseert de sleutels tot fragmentatie van metalen materialen Gemakkelijke manier om Flubber te maken
Gemakkelijke manier om Flubber te maken  Gaat natriumbromide elektriciteit in vloeibare toestand?
Gaat natriumbromide elektriciteit in vloeibare toestand?  Wat zijn twee manieren waarop atomen kunnen combineren om verbindingen te vormen?
Wat zijn twee manieren waarop atomen kunnen combineren om verbindingen te vormen?  Next-gen 3D-geprinte katalysatoren om hypersonische vlucht voort te stuwen
Next-gen 3D-geprinte katalysatoren om hypersonische vlucht voort te stuwen
 Bosbranden tijdens de overgang van het Perm naar het Trias veroorzaakten een vegetatieverandering in het ecosysteem
Bosbranden tijdens de overgang van het Perm naar het Trias veroorzaakten een vegetatieverandering in het ecosysteem Wat absorbeert de atmosfeer om de aarde te beschermen?
Wat absorbeert de atmosfeer om de aarde te beschermen?  Braziliaans Amazonegebied registreert minste septemberbranden in 20 jaar
Braziliaans Amazonegebied registreert minste septemberbranden in 20 jaar Hoe gebruiken natuurbeschermers wetenschap om te werken?
Hoe gebruiken natuurbeschermers wetenschap om te werken?  Wat is het abstracte zelfstandig naamwoord voor kennis?
Wat is het abstracte zelfstandig naamwoord voor kennis?
Hoofdlijnen
- Waarom moeten levende wezens nieuwe cellen produceren?
- Hoeveel krijgt een wetenschapper betaald door de biologie?
- Welke structuren hebben bacteriën XY?
- Wie zijn een Filipijnse wetenschapper en wat hun bijdrage aan de vooruitgang van de fysieke wetenschap?
- Welke eigenschappen die worden bestuurd door genen die zich op sekschromosomen bevinden, zijn wat voor soort eigenschappen?
- Hoe is een Cells DNA net als de boeken in een bibliotheek?
- Welk deel van DNA biedt de code voor eiwitten?
- De meeste ATP wordt geproduceerd als een proces wat?
- Een uiterlijk van de organismen of een ander detecteerbaar kenmerk?
- Chemici maken circulaire fluorescerende kleurstoffen voor biologische beeldvorming
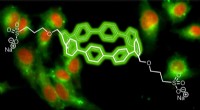
- Stikstof terugbrengen naar de bodem zonder chemicaliën

- Een verbeterde veiligheidsnorm voor bionische apparaten

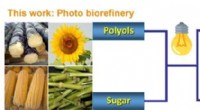
- Nieuwe fotokatalytische methode zet biopolyolen en suikers om in methanol en syngas
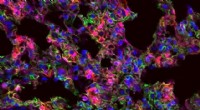
- Nieuwe materialen verbeteren de levering van therapeutisch boodschapper-RNA
 Onderzoekers ontdekken hoe ze protonen kunnen verplaatsen en de waterstofbrandstofceltechnologie kunnen verbeteren
Onderzoekers ontdekken hoe ze protonen kunnen verplaatsen en de waterstofbrandstofceltechnologie kunnen verbeteren  Invloed van aerodynamica op snelheid van een auto?
Invloed van aerodynamica op snelheid van een auto?  Hoe is kinetische energie gerelateerd aan massa?
Hoe is kinetische energie gerelateerd aan massa?  Ultrasterk knijpen van licht gedemonstreerd voor ultrasnelle optische signaalverwerking
Ultrasterk knijpen van licht gedemonstreerd voor ultrasnelle optische signaalverwerking Welke dag van het jaar is de hoogste hemel van de aarde?
Welke dag van het jaar is de hoogste hemel van de aarde?  Hoe u heeft bijgedragen aan het ontstaan van de crisis in privégegevens
Hoe u heeft bijgedragen aan het ontstaan van de crisis in privégegevens Wat zijn twee belangrijke methoden die klimatologen gebruiken om de aardes te achterhalen langs de klimaatgeschiedenis?
Wat zijn twee belangrijke methoden die klimatologen gebruiken om de aardes te achterhalen langs de klimaatgeschiedenis?  Wat zijn twee natuurlijke bronnen van het broeikaseffect?
Wat zijn twee natuurlijke bronnen van het broeikaseffect?
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap & Ontdekkingen © https://nl.scienceaq.com

