
Wetenschap
Wat bepaalt de stabiliteit of reactiviteit van een atoom?
1. Elektronenconfiguratie:
* octetregel: Atomen streven ernaar om een stabiele configuratie te bereiken met een volledige buitenste schaal van elektronen (meestal acht elektronen, vandaar de octetregel). Hierdoor reageren ze minder kans.
* valentie -elektronen: Het aantal elektronen in de buitenste schaal (valentie -elektronen) bepaalt hoe gemakkelijk een atoom elektronen kan winnen, verliezen of delen om een stabiele configuratie te bereiken.
* Elektronenaffiniteit: Hoe sterk een atoom trekt elektronen naar de buitenste schaal. Hogere elektronenaffiniteit duidt op een grotere stabiliteit.
2. Nucleaire lading:
* Effectieve nucleaire lading: De netto positieve lading ervaren door de valentie -elektronen. Een hogere effectieve nucleaire lading trekt elektronen sterker aan, waardoor het atoom stabieler wordt.
* Afscherming: Binnenste elektronenschild valentie -elektronen van de volledige nucleaire lading, waardoor de effectieve nucleaire lading wordt verminderd.
3. Ionisatie -energie:
* Energie vereist om een elektron uit een atoom te verwijderen: Hogere ionisatie -energie duidt op een grotere neiging van een atoom om zijn elektronen vast te houden, waardoor het minder reactief is.
4. Elektronegativiteit:
* neiging van een atoom om elektronen in een binding aan te trekken: Hogere elektronegativiteit duidt op een groter vermogen om elektronen aan te trekken, waardoor het atoom reactiever wordt.
5. Bindingssterkte:
* Sterkte van de bindingen Een atoom vormen: Sterkere bindingen dragen bij aan een grotere stabiliteit.
6. Grootte van het atoom:
* Atomische straal: Kleinere atomen hebben over het algemeen hogere ionisatie -energieën en sterkere attracties voor elektronen, waardoor ze stabieler worden.
7. Andere factoren:
* Nucleaire stabiliteit: Atomen met een hoge neutronen-protonverhouding zijn eerder onstabiel en radioactief.
* aanwezigheid van ongepaarde elektronen: Atomen met ongepaarde elektronen zijn eerder reactief.
Voorbeelden:
* Nobele gassen: Heb een volledige buitenste schaal van elektronen, waardoor ze zeer stabiel en niet -reactief zijn.
* halogenen: Heb zeven valentie -elektronen en een hoge elektronenaffiniteit, waardoor ze zeer reactief zijn.
* Alkali -metalen: Heb één valentie -elektron, verlies het gemakkelijk om een stabiel kation te vormen, waardoor ze zeer reactief zijn.
Samenvattend:
De stabiliteit of reactiviteit van een atoom hangt af van een complex samenspel van deze factoren. Atomen met een volledige buitenste schaal van elektronen, sterke nucleaire aantrekkingskracht en hoge ionisatie -energie zijn over het algemeen stabieler en minder reactief. Omgekeerd zijn atomen met een groot aantal valentie -elektronen, lage ionisatie -energie en ongepaarde elektronen meestal reactiever.
 Wat is de generalisatie van oplosbaarheid lipiden?
Wat is de generalisatie van oplosbaarheid lipiden?  Hoe beïnvloeden radioactieve nucliden fotografische film gewikkeld in lichtbestendig papier?
Hoe beïnvloeden radioactieve nucliden fotografische film gewikkeld in lichtbestendig papier?  Welke elementen maken magnesiumsulfaat?
Welke elementen maken magnesiumsulfaat?  1 Hoe weet u dat twee stoffen verschillende ladingen krijgen als ze samen worden gewreven?
1 Hoe weet u dat twee stoffen verschillende ladingen krijgen als ze samen worden gewreven?  De vorming van convectiestromen is te wijten aan veranderingen in dichtheidsdichtheid kunnen worden beschreven als?
De vorming van convectiestromen is te wijten aan veranderingen in dichtheidsdichtheid kunnen worden beschreven als?
 Wat is een natuurlijk proces geven voorbeelden?
Wat is een natuurlijk proces geven voorbeelden?  Welk bioom heeft de minste biodiversiteit?
Welk bioom heeft de minste biodiversiteit?  Hoe noem je de voortdurende dekking van bomen die jungle in een regenwoud overschaduwen?
Hoe noem je de voortdurende dekking van bomen die jungle in een regenwoud overschaduwen?  Tienduizenden geëvacueerd terwijl bosbranden Californië woeden
Tienduizenden geëvacueerd terwijl bosbranden Californië woeden NASA's IMERG meet zware regenval in natuurbrandgebieden in Californië
NASA's IMERG meet zware regenval in natuurbrandgebieden in Californië
Hoofdlijnen
- Welke kleurenbuis wordt gebruikt om lipase te tekenen?
- Wat zijn de dochtercellen?
- Hoe gebruik je het woord micro -organismen in een zin?
- Is elk orgel samengesteld uit zijn eigen weefsel?
- Welke structuren trekken de chromosomen uit elkaar?
- Waarom de verkeerde etikettering van de mondiale Rode Lijst een risico vormt voor veel soorten
- Welk deel van de watercyclus is een biologisch?
- Welke organellen hebben cellen?
- Waarom wiebelen planten? Nieuw onderzoek biedt antwoorden
- Als toekomstige batterijen, hybride supercondensatoren zijn supergeladen

- Optisch beeldvormingssysteem kan een ongekend aantal cellen in een enkele afbeelding vastleggen
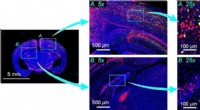
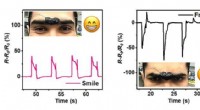
- Elektronische huid opgerekt tot nieuwe grenzen
- Kleurafstembare, zeer mobiele emitterende organische eenkristallen voor lichtemitterende transistors

- Wat als we krachtige medicijnen zouden kunnen ontwerpen zonder ongewenste bijwerkingen?

 Vallen voor energiebronmoleculen in cellen
Vallen voor energiebronmoleculen in cellen Wat gebeurt er als snelheid en versnelling niet in dezelfde richting zijn?
Wat gebeurt er als snelheid en versnelling niet in dezelfde richting zijn?  Wat zijn de twee namen die worden gebruikt bij het identificeren van organismen?
Wat zijn de twee namen die worden gebruikt bij het identificeren van organismen?  Hoeveel molens in één beker?
Hoeveel molens in één beker?  Is de naam voor het proces dat door witte bloedcellen wordt gebruikt om infectie te bestrijden?
Is de naam voor het proces dat door witte bloedcellen wordt gebruikt om infectie te bestrijden?  Studie daagt idee uit dat studenten met cognitieve beperkingen niet in STEM kunnen zitten
Studie daagt idee uit dat studenten met cognitieve beperkingen niet in STEM kunnen zitten Mannelijke en vrouwelijke brandweerlieden hebben verschillende problemen met beschermende pakken
Mannelijke en vrouwelijke brandweerlieden hebben verschillende problemen met beschermende pakken Welke rol spelen lipidemoleculen bij het semipermeabel maken van het celmembraan?
Welke rol spelen lipidemoleculen bij het semipermeabel maken van het celmembraan?
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap & Ontdekkingen © https://nl.scienceaq.com

