
Wetenschap
De temperatuur waarbij de deeltjes van een stof meer kinetische energie hebben om te transformeren is?
* smeltpunt: De temperatuur waarbij een vaste stof in een vloeistof verandert.
* kookpunt: De temperatuur waarbij een vloeistof in een gas verandert.
* Sublimatiepunt: De temperatuur waarbij een vaste stof rechtstreeks in een gas verandert en de vloeibare fase overslaat.
Kinetische energie en transformaties
Bij hogere temperaturen hebben deeltjes in een stof meer kinetische energie, wat betekent dat ze sneller bewegen en meer trillen. Deze verhoogde energie kan de krachten overwinnen die de deeltjes bij elkaar houden in hun huidige toestand, wat leidt tot een staatsverandering:
* vast tot vloeistof: De deeltjes in een vaste stof zijn strak verpakt en hebben een beperkte beweging. Naarmate de temperatuur toeneemt, trillen de deeltjes krachtiger en overwinnen uiteindelijk de aantrekkelijke krachten die ze in een vast rooster houden. Hierdoor kunnen ze vrijer bewegen, wat resulteert in een vloeibare toestand.
* vloeistof naar gas: De deeltjes in een vloeistof zijn nog steeds dicht bij elkaar, maar hebben meer bewegingsvrijheid. Naarmate de temperatuur toeneemt, krijgen deeltjes voldoende kinetische energie om te ontsnappen aan de aantrekkelijke krachten die ze in de vloeibare toestand houden. Ze gaan verder uit elkaar en worden een gas.
Belangrijke opmerking: De specifieke overgangstemperatuur is afhankelijk van de stof zelf en de omringende druk.
 Wetenschappers ontwikkelen nieuwe technologie om drinkwater te beschermen tegen algentoxines uit het Eriemeer
Wetenschappers ontwikkelen nieuwe technologie om drinkwater te beschermen tegen algentoxines uit het Eriemeer Hormesis en paradoxale effecten bij planten bij blootstelling aan formaldehyde zijn veelvoorkomende verschijnselen
Hormesis en paradoxale effecten bij planten bij blootstelling aan formaldehyde zijn veelvoorkomende verschijnselen Het weer op elke planeet
Het weer op elke planeet  Maar liefst 1,8 miljoen hectare verbrand in zeer ernstige branden tijdens de Black Summer van Australië
Maar liefst 1,8 miljoen hectare verbrand in zeer ernstige branden tijdens de Black Summer van Australië Een kleine aardbeving en Moodus-geluiden zijn niets nieuws voor een stad in Connecticut
Een kleine aardbeving en Moodus-geluiden zijn niets nieuws voor een stad in Connecticut
Hoofdlijnen
- Wat is het belangrijkste aspect van een hypothese?
- 3 weefsels die het vasculaire systeem vormen in een zaadplant?
- In welk stadium van de celcyclus komt divisie voor?
- Is eclips gelijk aan nacht in het plantenleven? Onderzoekers testen plantritmes tijdens zonsverduistering
- De effecten van temperatuur op enzymactiviteit en biologie
- Waarom meiose en gametogenese altijd onderling verbonden zijn?
- Hoe sociale media de menselijke beschaving hebben gesynchroniseerd
- Hoe vaak meerdere bacteriën meerdere?
- Verstikt, gewurgd en verdronken. Hoe plastic zakken met ballonnen zeedieren doden
- Materialen voor waterstofservice ontwikkeld door nieuw multilab-consortium

- Een nieuw materiaal voor de batterij van de toekomst

- De kans op succes in de synthetische chemie vergroten
- Hoe probiotische bifidobacteriën patiënten met coeliakie kunnen helpen?

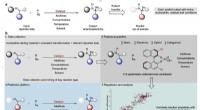
- Bestuderen van argongas gevangen in een tweedimensionale reeks kleine kooien
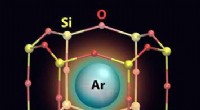
 Waarom maakt steenzout ijskoud?
Waarom maakt steenzout ijskoud?  Waterverwerking - nieuwe methode elimineert hormonen
Waterverwerking - nieuwe methode elimineert hormonen Niet -cyclische elektronenstroom resulteert in het genereren van wat?
Niet -cyclische elektronenstroom resulteert in het genereren van wat?  Waarom worden krachten niet uitgeoefend wanneer het object elkaar raakt?
Waarom worden krachten niet uitgeoefend wanneer het object elkaar raakt?  Welk land op het schiereiland Jutland is de kleinste staat?
Welk land op het schiereiland Jutland is de kleinste staat?  Hoe snel gaat een neushoorn?
Hoe snel gaat een neushoorn?  Fossiele apentanden openen een nieuw venster in oude seizoensklimaten
Fossiele apentanden openen een nieuw venster in oude seizoensklimaten Kaliumpermanganaat Experimenten
Kaliumpermanganaat Experimenten
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap © https://nl.scienceaq.com

