
Wetenschap
Hoeveel gram zuurstof zijn er nodig om te reageren met 2,5 dihydrogen sulfide?
1. Schrijf de gebalanceerde chemische vergelijking:
De reactie tussen dihydrogen sulfide (H₂s) en zuurstof (O₂) produceert zwaveldioxide (SO₂) en water (H₂o). De evenwichtige vergelijking is:
2 H₂s + 3 O₂ → 2 So₂ + 2 H₂o
2. Bepaal de molverhouding:
Uit de evenwichtige vergelijking zien we dat 2 mol H₂s reageren met 3 mol O₂.
3. Converteer gram van H₂s in mollen:
* Zoek de molaire massa van H₂s:1,01 g/mol (h) * 2 + 32.07 g/mol (s) =34,09 g/mol
* Converteer 2,5 g H₂s in mol:2,5 g / 34,09 g / mol =0,0733 mol H₂s
4. Bereken mol O₂ nodig:
* Gebruik de molverhouding van de gebalanceerde vergelijking:(0,0733 mol H₂s) * (3 mol O₂ / 2 mol H₂s) =0,110 mol O₂
5. Converteer mol O₂ om te grammen:
* Zoek de molaire massa van O₂:16.00 g/mol (o) * 2 =32,00 g/mol
* Converteer 0,110 mol O₂ naar gram:0,110 mol * 32,00 g/mol =3,52 g o₂
Daarom heeft u 3,52 gram zuurstof nodig om te reageren met 2,5 gram dihydrogen sulfide.
 Hoe verhoudt de dichtheid zich tot vloeibare lagen?
Hoe verhoudt de dichtheid zich tot vloeibare lagen?  Welk gas voldoet aan de wetten op alle omstandigheden van temperatuur en druk?
Welk gas voldoet aan de wetten op alle omstandigheden van temperatuur en druk?  Activiteit om aan te tonen dat water een slechte geleider van warmte is?
Activiteit om aan te tonen dat water een slechte geleider van warmte is?  Hoeveel valentie -elektronen bevinden zich in één neutraal atoom van waterstof?
Hoeveel valentie -elektronen bevinden zich in één neutraal atoom van waterstof?  Welk zuur zit er in clorex?
Welk zuur zit er in clorex?
 Algen als levensvatbaar alternatief voor voedsel, diervoeder en verzorgingsproducten
Algen als levensvatbaar alternatief voor voedsel, diervoeder en verzorgingsproducten Seismische gegevens leveren diepere aardbevingskennis op
Seismische gegevens leveren diepere aardbevingskennis op Onderzoeker ontdekt hoe je vrouwelijke interesse in wetenschapsstudie kunt aanwakkeren en behouden
Onderzoeker ontdekt hoe je vrouwelijke interesse in wetenschapsstudie kunt aanwakkeren en behouden  Rotsen worden afgebroken door waterlucht en levende organismen?
Rotsen worden afgebroken door waterlucht en levende organismen?  Welke soorten planten bevinden zich in het Midden-Amerikaanse tropische regenwoud?
Welke soorten planten bevinden zich in het Midden-Amerikaanse tropische regenwoud?
Hoofdlijnen
- Waarom hebben bladcellen zoveel bladgroenkorrels?
- Wat is een goede definitie voor diploïde cellen?
- Commensalisme: definitie, types, feiten en voorbeelden
- Waarom gebaren we?
- Wat hebben vleermuizen, priesters en rabbijnen gemeen? Netwerkanalyse levert inzichten op
- Wat zijn de namen van cellen in STEM?
- Welk deel van de huid bestaat voornamelijk dode cellen gevuld met een eiwit genaamd keratine om taai te blijven?
- Hoe microtubuli zich in nieuwe richtingen vertakken, een eerste blik op dieren
- Kan een parasiet pathogeen zijn?
- Wetenschappers gebruiken koolstofnanobuistechnologie om robuuste ontziltingsmembranen voor water te ontwikkelen
- Schuimbruis

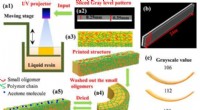
- 4D-printen van omkeerbare vormveranderende materialen met op licht gebaseerde grijswaardenpatronen
- Ontvriezen van water in ligandbindingsplaatsen om te helpen bij het ontdekken van geneesmiddelen

- Rekbare supercondensatoren om de draagbare apparaten van morgen van stroom te voorzien

 Verband gevonden tussen ouderschap en sociaal conservatisme
Verband gevonden tussen ouderschap en sociaal conservatisme Waarom knappen bubbels?
Waarom knappen bubbels?  Wetenschapsprojecten met een prisma
Wetenschapsprojecten met een prisma  Gaat de evenaar door Nieuw -Zeeland?
Gaat de evenaar door Nieuw -Zeeland?  De omgeving biedt twee soorten natuurlijke hulpbronnen- kapitaalbronnen en mensen zijn?
De omgeving biedt twee soorten natuurlijke hulpbronnen- kapitaalbronnen en mensen zijn?  Wat vormt chloor?
Wat vormt chloor?  Welk apparaat verandert mechanische energie in elektrische door een draadspoel door een magnetisch veld te roateren?
Welk apparaat verandert mechanische energie in elektrische door een draadspoel door een magnetisch veld te roateren?  Wat betekent het als menselijk DNA vergelijkbaar is met chimpansee -DNA?
Wat betekent het als menselijk DNA vergelijkbaar is met chimpansee -DNA?
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap © https://nl.scienceaq.com

