
Wetenschap
Waarom heeft een gas geen duidelijke vorm en volume?
1. Zwakke intermoleculaire krachten:
* Gasdeeltjes liggen ver van elkaar in vergelijking met vaste stoffen en vloeistoffen.
* De aantrekkelijke krachten tussen deze deeltjes (van der Waals -krachten) zijn erg zwak.
* Dit betekent dat de deeltjes vrij en onafhankelijk bewegen, met weinig interactie.
2. Constante willekeurige beweging:
* Gasdeeltjes zijn in constante, snelle en willekeurige beweging.
* Ze botsen met elkaar en de wanden van hun container, waardoor druk ontstaat.
* Deze beweging maakt het onmogelijk om ze tot een specifieke vorm te beperken.
3. De container vullen:
* Vanwege hun zwakke krachten en willekeurige beweging verspreiden gasdeeltjes zich om het gehele volume van hun container te vullen.
* Ze zullen zich uitbreiden om elke ruimte die ze krijgen te vullen.
In tegenstelling tot vaste stoffen en vloeistoffen:
* vaste stoffen: Hebben sterke intermoleculaire krachten, houden deeltjes vast in vaste posities, waardoor ze een duidelijke vorm en volume hebben.
* vloeistoffen: Hebben zwakkere krachten dan vaste stoffen, waardoor deeltjes zich kunnen verplaatsen, waardoor ze een duidelijk volume hebben, maar geen duidelijke vorm.
Denk er op deze manier aan:
Stel je een kamer vol mensen voor. Als iedereen strak in elkaar zit (zoals een vaste stof), hebben ze een duidelijke vorm en volume. Als iedereen rond staat maar nog steeds dichtbij is (zoals een vloeistof), hebben ze een duidelijk volume maar geen duidelijke vorm. Stel je nu voor dat iedereen vrij rondloopt en tegen elkaar tegenkomt (als een gas). Ze hebben geen duidelijke vorm of volume omdat ze constant bewegen en de hele ruimte van de kamer vullen.
Hoofdlijnen
- Neurowetenschapper onderzoekt 'Hoe het is om een hond te zijn'
- Wanneer een wetenschapper zijn of haar bevindingen deelt met andere wetenschappers, is het dan?
- Wie zijn de beroemde biotechnologen en hun bijdragen?
- Wat zijn het primaire gebruik voor lipiden in cel?
- Welke cel heeft vacuolen?
- Wat zijn de abstracte zelfstandige naamwoorden voor breed en sterk?
- Hoe diverse microbiële gemeenschappen stabiel blijven
- Je laat een microbe-vingerafdruk achter op elk kledingstuk dat je draagt – en het kan forensische wetenschappers helpen misdaden op te lossen
- Eenvoudig model verklaart waarom verschillende vierpotige dieren vergelijkbare gangen aannemen
- Continue monitoring van eiwitten een game-changer voor patiënten met snel verslechterende aandoeningen
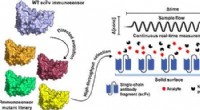
- Nieuw onderzoek verklaart waarom sommige moleculen onregelmatige vormen hebben

- Nieuw staal om de levensduur van olieveldpijpleidingen te verdubbelen

- Lang gezochte structuur van telomerase effent de weg voor nieuwe geneesmiddelen voor veroudering, kanker
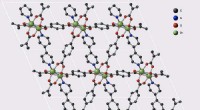
- Nieuwe materialen voor de opslag van brandbare industriële gassen
 Onderzoekers sporen nieuwe biokatalysatoren op
Onderzoekers sporen nieuwe biokatalysatoren op Was de Alpen veroorzaakt door vouwen?
Was de Alpen veroorzaakt door vouwen?  Wat is de reactiviteit van Americium?
Wat is de reactiviteit van Americium?  Hoe bruine ratten van schepen kropen en Noord-Amerikaanse steden veroverden
Hoe bruine ratten van schepen kropen en Noord-Amerikaanse steden veroverden  In het kielzog van Harvey, Houston moet de planningsregels wijzigen
In het kielzog van Harvey, Houston moet de planningsregels wijzigen NASA's CPEX pakt een fundamentele weersverandering aan
NASA's CPEX pakt een fundamentele weersverandering aan Wat is de familienaam van inktvis?
Wat is de familienaam van inktvis?  Hoe rugpijn te voorkomen
Hoe rugpijn te voorkomen
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap © https://nl.scienceaq.com


